
 ,
, ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、该反应的氧化剂只有CuSO4 | ||
| B、SO42-既不是氧化产物也不是还原产物 | ||
C、1 mol CuSO4还原了
| ||
| D、被还原的S和被氧化的S的质量比为7:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从1L 1mol/L的NaCl溶液中取出 10mL,其浓度仍是1mol/L |
| B、制成0.5 L 10 mol/L的盐酸,而要氯化氢气体112 L(标准状况) |
| C、0.5 L 2 mol/L BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023 |
| D、10g 98%的硫酸(密度为1.84 g/cm3)与10mL18.4mol/L硫酸的浓度是不同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2O(mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
c[Cu(NH3
| ||
| c(Cu2+)?c4(NH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(X)=0.03 mol/(L?min) |
| B、v(Y)=0.02 mol/(L?min) |
| C、v(Z)=0.10 mol/(L?min) |
| D、v(w)=0.20 mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
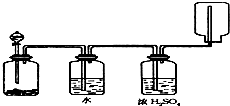 如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体,该装置可用于( )
如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体,该装置可用于( )| A、二氧化锰和双氧水反应生成氧气 |
| B、浓氨水和生石灰混合生成氨气 |
| C、Na2SO3和浓H2SO4混合生成SO2 |
| D、锌粒与稀盐酸混合生成H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com