
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
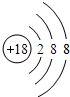 ,
, ;
;
| ||
| ||
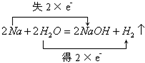 ,
,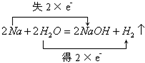 ;
;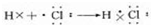 ,
,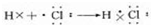 .
.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:
| A、将8.96L(标准状况)CO2通入100mL 3mol?L-1 NaOH溶液中:3CO2+4OH═CO32-+2HCO3-+H2O | ||||
| B、Fe3O4与足量稀HNO3反应:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O | ||||
C、用铁棒作阳极、炭棒作阴极电解饱和氯化钠溶液:2Cl-+2H2O
| ||||
| D、硫酸铝溶液和过量的氢氧化钡溶液混合Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 相关实验 | 预期目的 | |
| A. | 等质量的锌粒和锌片分别与等体积的盐酸反应 | 探究接触面积对化学反应速率的影响 |
| B. | 把装有颜色相同的NO2和N2O4混合气的两支试管(密封)分别浸入冷水和热水中 | 探究温度对化学平衡的影响 |
| C. | 向FeCl3和KSCN反应后的混合液中加入少量NaOH溶液 | 探究浓度对化学平衡的影响 |
| D. | 两支试管中各加入4mL0.01mol/LKMnO4酸性溶液和2mL0.1mol/LH2C2O4溶液,向其中一支试管中加入少量MnSO4固体 | 探究催化剂对反应速率的影响 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,原子的第一电离能E<A,R是地壳中含量最高的金属元素,X原子核外的M层中有三对成对电子,Y为周期表前四周期中电负性最小的元素,Z原子核外电子数为24.
有A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,原子的第一电离能E<A,R是地壳中含量最高的金属元素,X原子核外的M层中有三对成对电子,Y为周期表前四周期中电负性最小的元素,Z原子核外电子数为24.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将过量的NaOH溶液滴入同浓度的少量Ca(HCO3)2溶液中Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| B、向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全Ba2++OH-+H++SO42-=BaSO4↓+H2O |
C、服用阿司匹林过量出现水杨酸( )反应,可静脉注射碳酸氢钠溶液: )反应,可静脉注射碳酸氢钠溶液: |
| D、向FeI2溶液中加少量氯水 2Fe2++Cl2=2Fe3++2Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com