
 ,表示的分子式C6H14名称是2-甲基戊烷
,表示的分子式C6H14名称是2-甲基戊烷 .
. 分析 (1)根据该有机物的键线式写出分子式,根据系统命名法完成该有机物的命名;
(2)0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6mol,则该烃分子中N(C)=$\frac{0.6mol}{0.1mol}$=6、N(H)=$\frac{0.6mol×2}{0.1mol}$=12,据此确定该有机物分子式;
(2)烷烃中出现乙基,则主链至少含有5个C,据此写出该有机物的结构简式.
解答 解:(1) ,分子中含有6个碳原子,属于饱和烃,分子式为C6H14,该有机物主链上有5个C,2号C一个甲基,其名称为:2-甲基戊烷,
,分子中含有6个碳原子,属于饱和烃,分子式为C6H14,该有机物主链上有5个C,2号C一个甲基,其名称为:2-甲基戊烷,
故答案为:C6H14;2-甲基戊烷;
(2)0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6mol,则该烃分子中N(C)=$\frac{0.6mol}{0.1mol}$=6、N(H)=$\frac{0.6mol×2}{0.1mol}$=12,故该烃的分子式为:C6H12,
故答案为:C6H12;
(3)烷烃中含有乙基,则乙基至少在3号位,所以只有一个乙基且式量最小的烷烃的结构简式为: ,
,
故答案为: .
.
点评 本题考查了有机物分子式、结构简式的确定,题目难度不大,涉及有机物命名、有机物分子式、结构简式的计算,明确常见有机物的组成、结构与命名原则为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 光合作用是将光能转化为化学能的有效途径 | |
| B. | 煤,石油,天然气都是可再生的化石燃料 | |
| C. | 用植物秸秆制沼气是有效利用生物质能的方式之一 | |
| D. | 开发氢能,太阳能,风能,生物质能等是实现“低碳生活”的有效途径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.04mol•L-1 | B. | 0.04mol•L-1•s-1 | C. | 0.08mol•L-1 | D. | 0.08mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 要鉴别的物质组 | 试剂 | 方法 |
| A | NaCl/Na2CO3 | BaCl2溶液 | 观察是否产生沉淀 |
| B | NO2/Br2 | 湿润的淀粉碘化钾试纸 | 观察试纸是否变蓝色 |
| C | 乙醇/乙酸 | 新制氢氧化铜悬浊液 | 观察溶液是否变澄清 |
| D | CO2/SO2 | 品红溶液 | 观察溶液红色是否退去 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
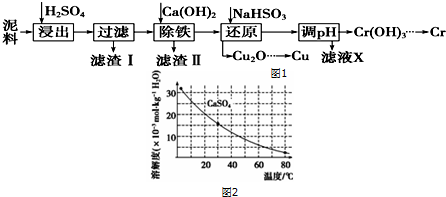
| 物质 | Fe3+ | Cu2+ | Cr3+ |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com