
下列说法不正确的是( )
A.粗铜电解精炼时,应将粗铜与直流电源的正极相连
B.金属的吸氧腐蚀的过程中,正极的电极反应式为O2+2H2O+4e-=4OH-
C.燃料电池中加入燃料的电极一定是电池的负极
D.在生产生活中,为保护钢铁器件免受腐蚀,应将该器件与直流电源的正极相连
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014高考化学苏教版总复习 专题9有机化合物的获取与应用练习卷(解析版) 题型:选择题
下列关于糖类的说法中正确的是( )
A.糖类都能发生水解反应
B.单糖都能发生银镜反应
C.葡萄糖与果糖是同分异构体,淀粉与纤维素也是同分异构体
D.单糖都能发生酯化反应
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:选择题
将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:H2NCOONH4(s)  2NH3(g)+CO2(g),在不同温度下,该反应平衡状态时的部分数据见下表。下列说法正确的是( )
2NH3(g)+CO2(g),在不同温度下,该反应平衡状态时的部分数据见下表。下列说法正确的是( )
温度 | 平衡浓度/(mol·L-1) | |
c(NH3) | c(CO2) | |
T1 | 0.1 |
|
T2 |
| 0.1 |
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,H2NCOONH4转化的Δn(T2)=2Δn(T1)
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题6化学反应与能量变化练习卷(解析版) 题型:填空题
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2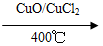 2Cl2+2H2O
2Cl2+2H2O
(1)已知:ⅰ.反应A中,4 molHCl被氧化,放出115.6 kJ的热量。
ⅱ.
①H2O的电子式是________。
②反应A的热化学方程式是______________________________________。
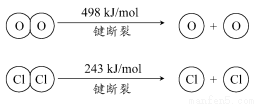
③断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为________kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”)________。
(2)对于反应A,下图是在4种投料比[n(HCl):n(O2),分别为1:1、2:1、4:1、6:1]下,反应温度对HCl平衡转化率影响的曲线。
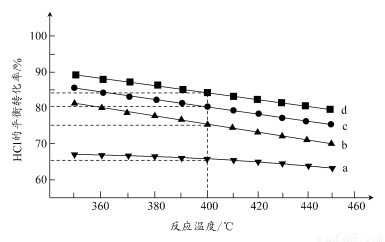
①曲线b对应的投料比是________。
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是______________________________。
③投料比为2:1、温度为400℃时,平衡混合气中Cl2的物质的量分数是________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题6化学反应与能量变化练习卷(解析版) 题型:选择题
某些化学键键能数据如下:
化学键 | H—H | Cl—Cl | H—Cl |
键能/ kJ·mol-1 | 436 | 243 | 431 |
则下列热化学方程式不正确的是( )
A. 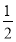 H2(g)+
H2(g)+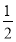 Cl2(g)=HCl(g) ΔH=-91.5 kJ·mol-1
Cl2(g)=HCl(g) ΔH=-91.5 kJ·mol-1
B.H2(g)+Cl2(g)=2HCl(g)ΔH=-183 kJ·mol-1
C. 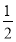 H2(g)+
H2(g)+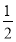 Cl2(g)=HCl(g)ΔH=+91.5 kJ·mol-1
Cl2(g)=HCl(g)ΔH=+91.5 kJ·mol-1
D.2HCl(g)=H2(g)+Cl2(g)ΔH=+183 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题6化学反应与能量变化练习卷(解析版) 题型:选择题
中华商务网讯:2011年中国将超北美成为全球液晶显示器第二大市场。生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年,以下是几种化学键的键能:
化学键 | N≡N | F—F | N—F |
键能/(kJ·mol-1) | 941.7 | 154.8 | 283.0 |
下列说法中正确的是( )
A.过程N2(g)→2N(g)放出能量
B.过程N(g)+3F(g)→NF3(g)放出能量
C.反应N2(g)+3F2(g)→2NF3(g)的ΔH>0
D.NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题5微观结构与物质的多样性练习卷(解析版) 题型:选择题
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
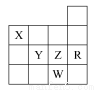
A.常压下五种元素的单质中W单质的沸点最高
B.Z元素的最高价氧化物对应的水化物酸性最强
C.X的氢化物比同族元素的氢化物沸点低
D.Y、Z和W的阴离子半径依次增大
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题3从矿物到基础材料练习卷(解析版) 题型:填空题
日常生活中使用的铝合金中的铝来自于电解氧化铝。工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。工业生产铝锭的工艺流程示意图如下:
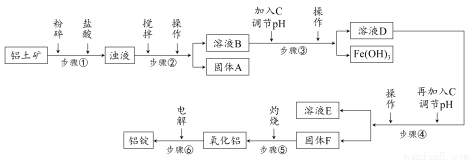
一些氢氧化物沉淀的pH如下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
开始沉淀pH(离子初始浓度0.01 mol/L) | 4 | 2.3 | 10.4 |
完全沉淀pH(离子浓度<10-5 mol/L) | 5.2 | 4.1 | 12.4 |
请回答下列问题:
(1)加入盐酸时,氧化铝发生反应的离子方程式为________________。
(2)实验室进行步骤②③④的操作名称为________。
(3)固体A的化学式为________,物质C的化学式为________;溶液中的Na+、Ca2+、Mg2+是在步骤________中分离出去的。
(4)步骤③调节pH的数值范围为________,步骤④调节pH的数值范围为________。
(5)步骤⑥反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题1化学家眼中的物质世界练习卷(解析版) 题型:填空题
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH、Ba2+、Al3+、Fe3+、Cl-、SO42-、CO32-,将该混合物溶于水后得澄清溶液,现取3份100 mL该溶液分别进行如下实验:
序号 | 实验内容 | 实验结果 |
1 | 加过量盐酸 | 无气体产生 |
2 | 加足量NaOH溶液并加热 | 收集到气体1.12 L(已折算成标准状况下的体积),并有红褐色沉淀生成,将沉淀过滤洗涤、干燥、灼烧,称重得1.60 g固体。 |
3 | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量 | 第一次称量读数为2.33 g |
试回答下列问题:
(1)根据实验1对CO32-是否存在的判断是________,(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断混合物中一定不存在的离子是________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
阴离子符号 | 物质的量浓度(mol·L-1) |
|
|
|
|
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com