
| A. | 在利用重结晶的方法制备KNO3的过程中,可在漏斗中加入酒精来洗涤 | |
| B. | 在石油的分馏实验中,冷凝管中冷水应从上口进入,热水从下口流出 | |
| C. | 粗盐提纯中,在溶解粗盐时,应用大量的水来溶解,以防止食盐不完全溶解 | |
| D. | 在分液实验中,待液体静置分层后,上、下层液体都应分别从分液漏斗下端的活塞放出 |
分析 A.硝酸钾在酒精中的溶解性较小且酒精易挥发;
B.分馏时,冷凝管中水应该从下口流入上口流出;
C.溶解食盐时需要加适量水;
D.分液时,上层液体从上口倒出,下层液体从下口倒出.
解答 解:A.硝酸钾在酒精中的溶解性较小且酒精易挥发,所以在利用重结晶的方法制备KNO3的过程中,可在漏斗中加入酒精来洗涤,减少硝酸钾损失,故A正确;
B.分馏时,冷凝管中水应该从下口流入上口流出,否则易炸裂冷凝管,故B错误;
C.溶解食盐时需要加适量水,如果溶液太稀,蒸发时耗时太长,故C错误;
D.分液时,上层液体从上口倒出,下层液体从下口倒出,否则易产生杂质,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及实验基本操作为重结晶、分馏、蒸发、分液,明确实验操作规范性及实验安全、实验原理是解本题关键,注意冷凝管中水流方向,为易错点.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
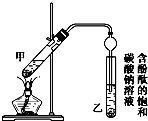 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 实验 | 乙醇(mL) | 乙酸(mL) | 乙酸乙酯(mL) |
| ① | 2 | 2 | 1.33 |
| ② | 3 | 2 | 1.57 |
| ③ | 4 | 2 | x |
| ④ | 5 | 2 | 1.76 |
| ⑤ | 2 | 3 | 1.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用甲烷和二氧化碳可以制备化工原料.
用甲烷和二氧化碳可以制备化工原料.| 物质 | H2 | CO | CH4 | CH3COOH |
| 燃烧热(kJ/mol) | 286 | 283 | 890 | 874 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | S>I2>Fe3+>Cl2 | B. | Cl2>Fe3+>I2>S | C. | Fe3+>Cl2>S>I2 | D. | Cl2>I2>Fe3+>S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质. |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一. |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物. |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 和
和
 和
和
| A. | ①④ | B. | ⑤⑦ | C. | ⑥⑧ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 替代,请将Br2与Na2CO3,反应的化学方程式补充完整:3Br2+3Na2CO3═1NaBrO3+5NaBr+3CO2
替代,请将Br2与Na2CO3,反应的化学方程式补充完整:3Br2+3Na2CO3═1NaBrO3+5NaBr+3CO2| 离子 | Na+ | Mg2+ | Cl- | SO${\;}_{4}^{2-}$ |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com