
分析 胃酸主要是盐酸,盐酸与氢氧化铝反应生成氯化铝和水,据此书写离子反应方程式Al(OH)3+3H+=Al3++3H2O;碳酸钙难溶,和盐酸反应生成氯化钙、水、二氧化碳;由此分析解答.
解答 解:胃酸主要是盐酸,盐酸与氢氧化铝反应生成氯化铝和水,据此书写离子反应方程式Al(OH)3+3H+=Al3++3H2O;碳酸钙难溶不可拆分,和盐酸反应生成氯化钙、水、二氧化碳,反应的离子方程式为CaCO3+2H+═Ca2++H2O+CO2↑,故答案为:Al(OH)3+3H+=Al3++3H2O;CaCO3+2H+═Ca2++H2O+CO2↑.
点评 本题考查钠的重要化合物,侧重于基础知识的考查,注意把握物质的性质以及反应的离子方程式的书写,难度不大,注意相关基础知识的积累.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
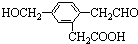 ,它在一定条件下可能发生的反应有( )
,它在一定条件下可能发生的反应有( )| A. | ②③④ | B. | ①③⑤⑥ | C. | ①③④⑤ | D. | ①③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使酸性高锰酸钾溶液及溴的四氯化碳溶液褪色原理相同 | |
| B. | 工业利用乙烯水化法制乙醇,是发生了取代反应 | |
| C. | 水果运输中为延长果实的成熟期,常在车厢里放置浸泡过高锰酸钾溶液的硅藻土 | |
| D. | 乙烯在空气中燃烧,发生火焰明亮并带有浓烟的火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子晶体中只含有共价键,离子晶体中只含有离子键 | |
| B. | 原子晶体的熔点一定比金属晶体的高 | |
| C. | 分子晶体熔化时,不破坏共价键;原子晶体熔化时,破坏共价键 | |
| D. | 任何晶体中,若含有阳离子就一定含有阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
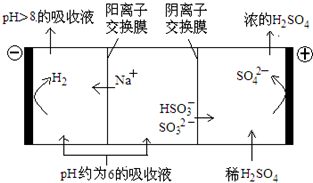
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知甲酸(HCOOH)是羧酸中组成最简单的酸,它具有羧酸的性质,在实验室里常用甲酸在浓硫酸的作用下制取少量一氧化碳,现用甲酸与甲醇反应制取甲酸甲酯来验证甲酸具有能发生酯化反应的性质,装置如图所示.
已知甲酸(HCOOH)是羧酸中组成最简单的酸,它具有羧酸的性质,在实验室里常用甲酸在浓硫酸的作用下制取少量一氧化碳,现用甲酸与甲醇反应制取甲酸甲酯来验证甲酸具有能发生酯化反应的性质,装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+8+m-n | B. | a+16-m+n | C. | a+24-m-n | D. | a+18-m-n |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 变化的化学方程式是:NaCl03+KCl=KClO3(结晶)+NaCl | |
| B. | KClO3是难溶物 | |
| C. | KClO3是比NaClO3更弱的电解质 | |
| D. | 相同温度下,KCl03的溶解度比NaCl03小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com