
| A、PM2.5是指大气中直径小于或等于2.5微米的颗粒物,PM2.5比胶体粒子小,因其比表面积大,故可吸附重金属离子,入肺后对人体产生很大的危害 |
| B、硫酸工业中,从吸收塔上部导出的气体再次通入接触室进行二次氧化,进一步吸收后,二氧化硫的含量很少,可直接排放到空气中 |
| C、以NO和NO2为主的氮氧化物是形成光化学烟雾和酸雨的一个重要原因 |
| D、高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |


科目:高中化学 来源: 题型:
| A、一定含有SO42- |
| B、一定含有Ag+ |
| C、一定不含CO32- |
| D、可能含有SO42-或Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、最终得到的溶液中:C(Na+)=C(Cl-)+C(OH-) |
| B、反应过程中得到标准状况下气体的体积为7.84L |
| C、最终得到C(Na+)=1.5mol/L |
| D、最终得到沉淀为Al(OH)3,质量是7.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钡 | B、氯化钡 |
| C、硝酸钡 | D、氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
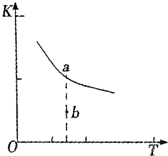 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MnO2CuO FeO |
| B、Na2CO3CaCO3 K2CO3 |
| C、AgNO3KNO3 Na2CO3 |
| D、(NH4)2SO4 K2SO4 NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 578 | 1817 | 2745 | 11575 |
| A、元素X的常见化合价是+1 |
| B、元素Y是ⅢA族元素 |
| C、元素X与氯形成化合物时,化学式可能是XCl |
| D、若元素Y处于第3周期,它可与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制曲线.请分析讨论以下问题.
为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制曲线.请分析讨论以下问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com