
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol/L NaOH溶液
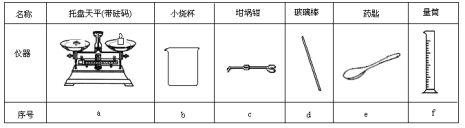
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体______g。
(2)从下表中选择称量NaOH固体所需要的仪器是(填字母):____。
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
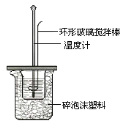
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):_____。
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
温度 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | _____ |
2 | 27.0 | 27.4 | 27.2 | 31.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热△H=___(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【答案】5.0 a b e ![]() 4.0 -53.5 kJ/mol a c d
4.0 -53.5 kJ/mol a c d
【解析】
Ⅰ.(1)要使用245mL NaOH溶液,应使用250mL容量瓶,根据该体积进行计算;
(2)NaOH固体具有一定的腐蚀性且易潮解,应在烧杯中称量,称量时选择托盘天平,取用药品时还需使用药匙;
Ⅱ.(1)根据中和热的定义书写热化学方程式;
(2)①由表格中的数据可知,第2组数据误差较大,去掉该组数据后求平均值进行计算;
起始温度t1的平均值为![]() =26.1℃,终止温度t2的平均值为
=26.1℃,终止温度t2的平均值为![]() =30.1℃,因而温度差为30.1-26.1=4.0℃;
=30.1℃,因而温度差为30.1-26.1=4.0℃;
②根据△H=![]() =
=![]() 进行计算;
进行计算;
③a. 实验的成功与否与热量损失的多少密不可分;
b. 量取NaOH溶液的体积时仰视读数,测量得溶液体积偏大;
c. 分次加入液体,热量损失过多,尽量一次性倒入;
d. 温度计上粘有的氢氧化钠与硫酸反应,使硫酸的起始温度偏高。
Ⅰ.(1)要使用245mL NaOH溶液,应使用250mL容量瓶,需要称量NaOH固体的质量m=cVM=0.50mol/L×0.25L×40g/mol=5.0g;
(2)NaOH固体具有一定的腐蚀性且易潮解,应在烧杯中称量,称量时选择托盘天平,取用药品时还需使用药匙,故选择abe;
Ⅱ.(1)根据中和热的定义得热化学方程式为: ![]() ;
;
(2)①起始温度t1的平均值为![]() =26.1℃,终止温度t2的平均值为
=26.1℃,终止温度t2的平均值为![]() =30.1℃,因而温度差为30.1-26.1=4.0℃;
=30.1℃,因而温度差为30.1-26.1=4.0℃;
②△H=![]() =
=![]() =
=![]() = -53.5 kJ/mol
= -53.5 kJ/mol
②③a. 实验的成功与否与热量损失的多少密不可分;
b. 量取NaOH溶液的体积时仰视读数,测量得溶液体积偏大,放出的热量偏高;
c. 分次加入液体,热量损失过多,尽量一次性倒入;
d. 温度计上粘有的氢氧化钠与硫酸反应,使硫酸的起始温度偏高;
故答案选acd。


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A+3B![]() 2C若维持温度和压强不变,当达到平衡时,容器的体积为V升,其中C气体的体积占10%,下列推断正确的是( )
2C若维持温度和压强不变,当达到平衡时,容器的体积为V升,其中C气体的体积占10%,下列推断正确的是( )
①原混和气体的体积为1.2V升;
②原混和气体的体积为1.1V升;
③反应达平衡时气体A消耗掉0.05V升;
④反应达平衡时气体B消耗掉0.05V升。
A.②③B.②④C.①③D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某难溶性盐X(仅含三种常见元素)的组成,设计并完成以下实验(流程中部分物质已略去):
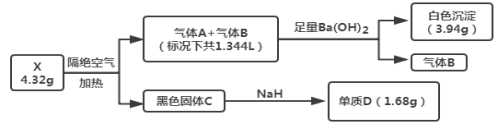
已知:气体A和气体B所含元素相同,都是无色无味气体,固体C为纯净物且具有磁性,单质D是目前建筑行业应用最广泛的金属。
根据上述信息,回答下列问题:
(1)盐X的化学式为____,B的化学式为____。
(2)无水条件下,少量NaH就能与固体C反应并放出大量的热,写出该反应的化学方程式:____。
(3)将产生的气体A全部被100mL0.35mol·L-1氢氧化钠溶液充分吸收,反应的总离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种重要的清洁燃料,也可替代氟氯昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________。
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)=CH3OH(g);△H=-90.8kJ·mol-1
②2CH3OH(g)=CH3OCH3(g)+H2O(g);△H=-23.5kJ·mol-1
③CO(g)+H2O(g)=CO2(g)+H2(g);△H=-41.3kJ·mol-1
总反应:3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)的△H=________________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________________(填字母代号)。
A.高温高压 B.加入催化剂 C.减少CO2的浓度 D.增加CO的浓度 E.分离出二甲醚
(3)下列可以说明反应③CO(g)+H2O(g)![]() CO2(g)+H2(g)已经达到平衡状态的是________________(填字母代号)。
CO2(g)+H2(g)已经达到平衡状态的是________________(填字母代号)。
A.单位时间内一个H-H键断裂的同时有两个H-O键断裂
B.H2O与CO2的浓度相等
C.温度和体积一定时,容器内的压强保持不变
D.条件一定时,混合气体的平均相对分子质量不再变化
E.温度和体积一定时,CO的浓度保持不变
(4)已知反应②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
若加入CH3OH后,经过10min反应达到平衡,此时c(CH3OH)=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二铟(In2O3)是一种透明的导电材料,可运用于接触屏、液晶显示器等高科技领域;铟产业被称为“信息时代的朝阳产业”。利用水铟矿[主要成分In(OH)3,常温下Ksp[In(OH)3]=l.41×10-33]制备In2O3的工艺流程如下:

(1)写出水铟矿被硫酸酸浸的离子方程式_____________________________。
(2)从硫酸铟溶液中制备硫酸铟晶体的实验步骤:________、_______、过滤、洗涤、干燥。
(3)某研究机构用硫酸提取铟时,酸度(每升溶液中含硫酸的质量)与浸出率关系如图

①当酸度为196时,硫酸物质的量浓度为______________。
②请选择适宜的酸度值:___________,并说明选择的理由____________。
(4)完成下列方程式:
(_____)In(NO3)3![]() (_____)In2O3+(_____) _______↑+(_____) _______↑
(_____)In2O3+(_____) _______↑+(_____) _______↑
(5)高纯铟与浓硝酸反应过程中产生的NO2气体可被过氧化钠直接吸收,则标准状况下448mlNO2可被______gNa2O2吸收,NO2的排放会引起一系列的环境问题,任写一条其引起的环境问题___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由短周期元素组成的中学常见无机物A、B、C、D、E、X,存在如图转化关系(部分生成物和反应条件略去),下列推断不正确的是( )
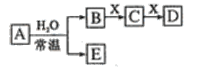
A.若D为CO,C能和E反应,则A一定为![]() ,其电子式
,其电子式![]()
B.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
C.若A是单质,B和D的反应是OH-+HCO3-=H2O+CO32-,则E一定能还原Fe2O3
D.若X是Na2CO3,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用下图装置探究SO2和Fe(NO3)3溶液的反应原理。其中Na2SO3放在三颈烧瓶中,下列说法不正确的是( )
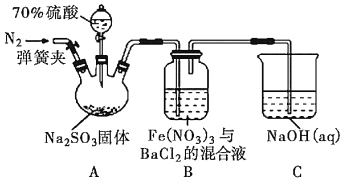
A.装置B中若产生白色沉淀,说明Fe3+能将SO2氧化成SO42-
B.实验室中配制70%的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒
C.三颈烧瓶中通入N2的操作应在滴加浓硫酸之前,目的是排尽装置内的空气
D.装置C可能发生倒吸,同时还不能完全吸收反应产生的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X溶液中只可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的一种成几种,取该溶液进行实验,实验内容和相关数据
中的一种成几种,取该溶液进行实验,实验内容和相关数据![]() 气体体积在标准状况下测定
气体体积在标准状况下测定![]() 如下:
如下:

![]() 溶液中一定不存在的离子是______。
溶液中一定不存在的离子是______。
![]() 已知气体D为NO,加入过量
已知气体D为NO,加入过量![]() 和
和![]() 溶液时,发生反应的离子方程式为______。
溶液时,发生反应的离子方程式为______。
![]() 溶液中
溶液中![]() ______
______![]() ,
,![]() ______
______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Al与CuCl2溶液反应,实验如下:下列说法不正确的是( )
实验 | 现象 |
| a.Al片表面附着蓬松的红色固体 b.产生无色气体,起始速率较慢,之后加快 c.反应放热 d.烧杯底部产生少量不溶于稀盐酸的白色沉淀 e.溶液pH降低 |
A.无色气体是H2
B.实验中影响化学反应速率的因素只有两个,分别是浓度和温度
C.白色沉淀的出现与氧化还原反应有关
D.将铝片改为铝粉会加快化学反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com