

分析 (1)由题Al4C3与水接触,会很快放出易燃气体甲烷,并生成氢氧化铝,生成的氢氧化铝与氢氧化钠反应生成偏铝酸钠;
(2)测定样品中Al4C3的纯度原理是用足量氢氧化钠与样品中Al4C3完全反应,量取生成的甲烷气体,从而可测得Al4C3的百分含量,样品中AlN与氢氧化钠反应生成氨气,排除氨气的干扰即可;
(3)有气体参与的实验要先检查装置的气密性;
(4)D装置吸收氨气,根据氨气的性质分析;
(5)C装置测定生成甲烷的体积,根据甲烷的溶解性分析;
(6)①样品完全溶解且氢氧化钠也恰好完全反应,最终生成NaAlO2,根据原子守恒,钠原子与铝原子质量相等,据此计算;
②如果将a处夹住,则滴加的液体体积也会排出一定量的液体,所以导致测得的气体体积偏大.
解答 解:(1)Al4C3与过量氢氧化钠溶液反应,Al4C3与水反应生成甲烷和氢氧化铝,生成的氢氧化铝与氢氧化钠反应生成偏铝酸钠,反应为:Al4C3+4NaOH+4H2O=4 NaAlO2+3CH4↑;
故答案为:Al4C3+4NaOH+4H2O=4 NaAlO2+3CH4↑;
(2)测定样品中Al4C3的纯度原理是用足量氢氧化钠与样品中Al4C3完全反应,量取生成的甲烷气体,从而可测得Al4C3的百分含量,而样品中AlN与氢氧化钠反应生成氨气,排除氨气的干扰即可,故用A装置将样品与氢氧化钠反应,用D装置盛放浓硫酸吸收氨气,用C装置测定生成的甲烷;
故答案为:D;
(3)有气体参与的实验要先检查装置的气密性;
故答案为:检查装置气密性;
(4)D装置吸收氨气确定生成氨气的量,氨气为碱性气体极易溶于水,故选择浓硫酸可充分吸收,同时为防止倒吸,D装置接一个球形干燥管;
故答案为:浓硫酸;吸收氨气;防止倒吸;
(5)C装置测定生成甲烷的体积,装置中的X不能溶解甲烷,甲烷不溶于水,故X为水;
故答案为:B;
(6)①样品中含铝元素的质量是13.5g,n(Al)=0.5mol,滴加100mL氢氧化钠溶液,样品完全溶解且氢氧化钠也恰好完全反应,最终生成NaAlO2,根据原子守恒,钠原子与铝原子质量相等,则n(Na)=0.5mol,则所加氢氧化钠溶液的物质的量浓度为0.5mol÷0.1L=5mol/L;
故答案为:5mol/L;
②如果将a处夹住,装置内压强变化则滴加的液体体积也会排出一定量的液体,所以导致测得的气体体积偏大;
故答案为:偏大.
点评 本题考查了物质含量的测定探究实验设计和实验分析判断,把握实验基本操作和物质性质是解题关键,题目难度中等,注意把握实验原理以及各部操作的目的,侧重于考查学生的实验能力和计算能力.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
| 元素 | 元素的相关信息 |
| M | 最高价氧化物对应水化物能与其气态氢化物反应生成盐 |
| W | 原子的M电子层上有3个电子 |
| X | 在短周期元素中,其原子半径最大 |
| Y | 最外层电子数是电子层数的2倍,且低价氧化物能与其气态氢化物反应生成Y的单质和H2O |
| Z | 元素最高正价与最低负价的代数和为6 |
| A. | M、Y、Z的简单离子半径依次增大 | |
| B. | W与Z形成的化合物属于离子化合物,其水溶液显酸性 | |
| C. | 化合物X2Y2、Y2Z2的晶体类型相同,化学键类型也相同 | |
| D. | M、W、X的最高价氧化物对应水化物两两之间能相互发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为加快漂粉精的漂白速率,使用时可滴加几滴醋酸 | |
| B. | 用作荧光灯内壁保护层的氧化铝纳米材料属于胶体 | |
| C. | “玉兔号”月球车太阳能电池帆板的材料是二氧化硅 | |
| D. | 海水中提溴的过程不涉及氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
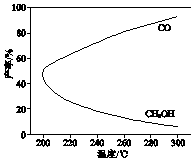 在一定条件下,利用CO2合成CH3OH的反应如下:
在一定条件下,利用CO2合成CH3OH的反应如下:| A. | △H1<0,△H2>0 | |
| B. | 增大压强有利于加快合成反应的速率 | |
| C. | 生产过程中,温度越高越有利于提高CH3OH的产率 | |
| D. | 合成CH3OH反应的平衡常数表达式是K=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了使豆腐白嫩和富有弹性,制作时可使用吊白块(具有漂白性)和烧碱 | |
| B. | 金属Mg失火时不能用泡沫灭火器扑灭 | |
| C. | 土壤胶粒带负电荷,有利于铵态氮肥的吸收 | |
| D. | 水玻璃可用于生产黏合剂和防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解过程中OH-向阴极迁移 | |
| B. | 阳极反应式为:4OH--4e-=O2↑+2H2O | |
| C. | 毎有l mol电子转移,生成标准状况下5.6L气体 | |
| D. | 电解过程中阴极区溶液的pH降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定存在SO42-、SO32-、NH4+,可能存在Na+ | |
| B. | 一定存在SO42-、SO32-、NH4+,一定不存在Cl-、Na+ | |
| C. | 溶液中可能含有Cl-,且Na+浓度至少为0.15mol•L-1 | |
| D. | c(SO42-)=0.1mol•L-1,c(NH4+)<c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
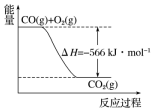 已知:
已知:| A. | CO的燃烧热为283kJ | |
| B. | 图可表示由1molCO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452 kJ•mol-1 | |
| D. | 根据以上热化学方程式无法求算Na2O2(s)+CO(g)═Na2CO3 (s) 的反应热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com