
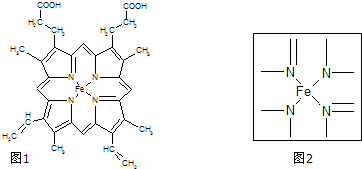
| A-B | A═B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| N2 | 154.8 | 418.4 | 941.7 |
 (或
(或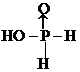 ),故答案为:
),故答案为: (或
(或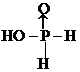 );
); ,故答案为:sp2 、sp3;
,故答案为:sp2 、sp3; ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有脱水性 |
| B、浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 |
| C、稀释浓硫酸时应将水沿着烧杯壁慢慢地注入盛有浓硫酸的烧杯中,并不断搅拌 |
| D、浓硫酸能与铜反应,说明浓硫酸有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、K+、SO42-、CO32- |
| B、Cu2+、K+、SO42-、NO3- |
| C、Na+、K+、Cl-、NO3- |
| D、K+、MnO4-、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,11.2 L氧气所含的原子数为NA |
| B、1.8 g的NH4+离子中含有的电子数为NA |
| C、常温常压下,32g O2含有的氧原子数为3NA |
| D、4.6g金属钠变为钠离子时失去的电子数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com