
A.30 ℃,100 mL 0.01 mol·L-1CH3COOH
B.40℃,50 mL 0.01 mol·L-1CH3COOH
C.50 ℃,30 mL 0.01 mol·L-1CH3COOH
D.20 ℃,500 mL 0.01 mol·L-1CH3COOH
科目:高中化学 来源: 题型:阅读理解
| ||
|
| NO | - 3 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省高三上学期12月月考化学试卷(解析版) 题型:填空题
I.设反应①Fe(s)+CO2(g)  FeO(s)+CO(g)的平衡常数为K1。
FeO(s)+CO(g)的平衡常数为K1。
反应②Fe(s)+H2O(g)  FeO(s)+H2(g)的平衡常数为K2,
FeO(s)+H2(g)的平衡常数为K2,
在不同温度下,K1、K2的值如下:
|
T(K) |
K1 |
K2 |
|
973 |
1.47 |
2.36 |
|
1173 |
2.15 |
1.67 |
(1)现有反应③CO2(g)+H2(g)
 CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有
(填序号)。
CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有
(填序号)。
A.缩小反应容器容积
B.扩大反应容器容积
C.降低温度
D.升高温度
E.使用合适的催化剂
F.设法减少CO的量
(2)若反应Fe(s)+CO2(g)
 FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
 FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率
(填序号)
FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率
(填序号)
A.前者大 B.后者大 C.一样大 D.无法判断
II.(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。则100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=________mol·L-1,KW(25℃)________KW(100℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4HCO3固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
|
化学式 |
电离平衡常数(25℃) |
|
HCN |
K=4.9×10-10 |
|
CH3COOH |
K=1.8×10-5 |
|
H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为 ____。
②25 ℃时,相同浓度、相同体积的CH3COOH溶液和NaOH溶液混合, 则混合溶液中c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省高三5月第一次模拟考试理综化学试卷(解析版) 题型:填空题
研究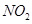 、
、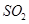 、CO等大气污染气体的测量及处理具有重要意义。
、CO等大气污染气体的测量及处理具有重要意义。
(1)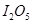 可使
可使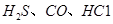 等氧化,常用于定量测定CO的含量。已知:
等氧化,常用于定量测定CO的含量。已知:
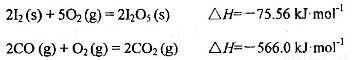
写出CO(g)与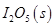 反应生成
反应生成 的热化学方程式:________________。
的热化学方程式:________________。
(2)CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,K+移向_______极(填“正”或“负”),正极反应方程式为:___________________。
(3)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷
酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料。
①该复合肥料可能的化学式为___________(写出一种即可)。
②若氨水与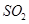 恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。
恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。
常温下弱电解质的电离平衡常数如下:氨水
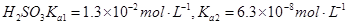
③向②中溶液中通入________气体可使溶液呈中性。(填“SO2”或NH3”)
此时溶液中 ________2(填“>”“<”或“=”)
________2(填“>”“<”或“=”)
(4)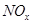 可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将
可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将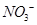 还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。
还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
I.设反应①Fe(s)+CO2(g) ![]() FeO(s)+CO(g)的平衡常数为K1。
FeO(s)+CO(g)的平衡常数为K1。
反应②Fe(s)+H2O(g) ![]() FeO(s)+H2(g)的平衡常数为K2,
FeO(s)+H2(g)的平衡常数为K2,
在不同温度下,K1、K2的值如下:
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
(1)现有反应③CO2(g)+H2(g) ![]() CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有 (填序号)。
CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有 (填序号)。
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(2)若反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g) ![]() FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率
FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率
(填序号)
A.前者大 B.后者大 C.一样大 D.无法判断
II.(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。则100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=________mol·L-1,KW(25℃)________KW(100℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4HCO3固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。

(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为_______ ____。
②25 ℃时,相同浓度、相同体积的CH3COOH溶液和NaOH溶液混合,
则混合溶液中c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为
___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013年山东省实验中学高考化学一模试卷(解析版) 题型:解答题
 ______2(填“>”“<”或“=”)
______2(填“>”“<”或“=”) 还原为NO,写出该过程中产生NO反应的离子方程式______.
还原为NO,写出该过程中产生NO反应的离子方程式______.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com