
【题目】现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥E、C同主族,且E比C多两个电子层,E单质可与冷水反应生成氢气。
试回答:
(1)写出元素C、E的名称:C______;E______。
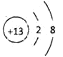
(2)画出A的原子结构示意图______,B的离子结构示意图______,D的单质分子的电子式______。
(3)写出B2A3分别与盐酸和氢氧化钠溶液反应的离子方程式:
____________________;___________________。
(4)比较B、C、E三种元素形成的简单离子半径的大小和氧化性的强弱(用离子符号表示):离子半径:_____________;氧化性:____________。
(5)写出E与冷水反应的化学方程式:_____________________。
【答案】钾 铯 
![]() Al2O3+6H+=2Al3++3H2O Al2O3+2OH-=2AlO2-+H2O Cs+>K+>Al3+ Al3+>K+>Cs+ 2Cs+2H2O=2CsOH+H2↑
Al2O3+6H+=2Al3++3H2O Al2O3+2OH-=2AlO2-+H2O Cs+>K+>Al3+ Al3+>K+>Cs+ 2Cs+2H2O=2CsOH+H2↑
【解析】
A、B、C、D、E五种元素它们的质子数依次增多,①A的核电荷数大于2可形成氢化物H2A该氢化物在常温下是液体则A为氧元素;②A和B两元素可形成B2A3化合物该化合物既能溶于强酸又能溶于强碱则B为铝元素;③B为铝元素,C+离子比B3+离子多8个电子则C为钾元素;④C与D元素可以形成化合物CD;⑤CD的溶液中通入氯气后加淀粉溶液显蓝色,则D为碘元素;⑥C为钾元素在周期表中E处于C的下两个周期E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为2:1则E为+1价金属与钾元素同主族,则E为Cs元素。
(1)由上述分析可知C是钾、E是铯;
(2)氧原子的结构示意图 ;
;
,B是铝元素铝离子有2个电子层核内质子数为13最外层有8个电子铝离子结构示意图![]() ;
;
,D为碘元素D的单质分子的电子式为![]() ;
;
(3) Al2O3分别与盐酸和氢氧化钠溶液反应的离子方程式Al2O3+6H+=2Al3++3H2O;Al2O3+2OH-=2AlO2-+H2O;
(4) 电子层数越多半径越大,Al3+、K+、Cs+三种离子半径Cs+>K+>Al3+;元素金属性Al<K<Cs所以BCE三种元素形成的简单离子氧化性Al3+>K+>Cs+;
(5)Cs与冷水反应的化学方程式2Cs+2H2O=2CsOH+H2↑。


科目:高中化学 来源: 题型:
【题目】富铁铝土矿(主要含有A12O3、Fe2O3、FeO和SiO2)可用于制备净水剂明矾KAl(SO4)2·12H2O和补血剂FeSO4·7H2O。工艺流程如下(部分操作和产物略去):
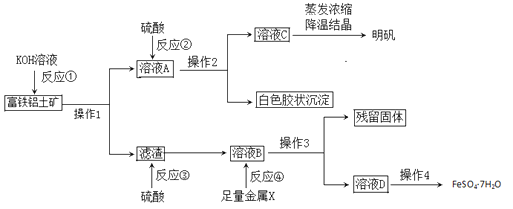
(1)操作1的名称是___________。
(2)反应①②③④中是氧化还原反应的是_______(填写编号)。
(3)综合考虑,金属X最好选择的试剂是__,写出该反应离子方方程式_______。
(4)反应①的离子方程式是_________、__________。
(5)溶液D中含有的金属阳离子是_______,检验方法是________。
(6)用含铝元素27℅的上述矿石10吨,通过上述流程最多生产明矾____吨。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A. 用过量氨水吸收工业尾气中的SO2:2NH3H2O+SO2=2NH4++SO32-+H2O
B. 氯化钠与浓硫酸混合加热:H2SO4+2Cl-![]() SO2↑+Cl2↑+H2O
SO2↑+Cl2↑+H2O
C. 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O
D. 明矾溶液中滴入Ba(OH)2溶液使SO42-,恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图的说法不正确的是( )
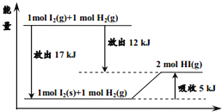
A. 1mol固态碘与![]() 化合生成2molHI气体时,需要吸收5kJ的能量
化合生成2molHI气体时,需要吸收5kJ的能量
B. 2molHI气体分解生成1mol碘蒸气与![]() 时需要吸收12kJ的能量
时需要吸收12kJ的能量
C. 1mol固态碘变为1mol碘蒸气时需要吸收17kJ的能量
D. 碘蒸气与![]() 生成HI气体的反应是吸热反应
生成HI气体的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇(结构简式: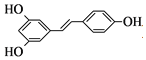 )属二苯乙烯类多酚化合物,具有抗氧化、抗癌和预防心血管疾病的作用。某课题组提出了如下合成路线:
)属二苯乙烯类多酚化合物,具有抗氧化、抗癌和预防心血管疾病的作用。某课题组提出了如下合成路线:
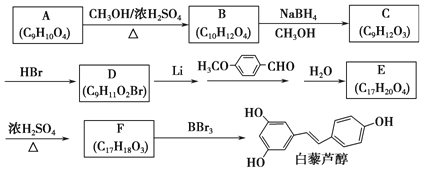
已知:①RCH2Br +![]()
②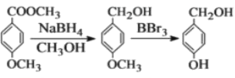
根据以上信息回答下列问题:
(1)白藜芦醇的分子式是_________
(2)C→D的反应类型是:__________;E→F的反应类型是______。
(3)化合物A不与FeCl3溶液发生显色反应,能与NaHCO3溶液反应放出CO2,推测其核磁共振谱(1H-NMR)中显示不同化学环境的氢原子个数比为_______(从小到大)。
(4)写出A→B反应的化学方程式:_____________;
(5)写出结构简式;D________、E___________;
(6)化合物![]() 符合下列条件的所有同分异构体共________种,
符合下列条件的所有同分异构体共________种,
①能发生银镜反应;②含苯环且苯环上只有两种不同化学环境的氢原子。
写出其中不与碱反应的同分异构体的结构简式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对CH4与Cl2的反应(如图所示)叙述不正确的是
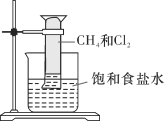
A. 该反应的生成物有四种
B. 该反应属于取代反应
C. 该反应的条件是光照
D. 该反应的现象是量筒内气体颜色变浅,器壁上有油状液滴,量筒内液面上升并产生白雾,溶液中有晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学原理正确的是( )
A. 沸点:HF>HCl>HBr>HI
B. 一定条件下![]() 可以自发进行,则
可以自发进行,则![]()
C. 常温下,![]() 溶液加水,水电离的
溶液加水,水电离的![]() 保持不变
保持不变
D. 标况下,1mol![]() 分别与足量Na和
分别与足量Na和![]() 反应,生成气体的体积比为
反应,生成气体的体积比为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请写出相应化学方程式,并写出前三个反应的反应类型。
(1)乙烯水化法制乙醇:_______________;反应类型:__________________________。
(2)溴乙烷在氢氧化钠醇溶液中加热:_______________;反应类型:__________________________。
(3)苯与液溴在一定条件下反应:___________________________(注明条件);反应类型:__________________________。
(4)苯酚钠与少量二氧化碳的反应:_________________。
(5)乙醛与银氨溶液反应制银镜:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究化合物A(仅含三种元素,摩尔质量为198g/mol)的组成与性质,设计并完成以下实验:取3.96g化合物A溶于水中,一段时间后全部转化为B(红褐色沉淀)、C(一种碱)和气体单质D(可使带火星的木条复燃),向溶液中加入100mL 0.6mol/L稀硫酸,再加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将沉淀洗涤后充分灼烧,得到红棕色固体粉末1.60g;将所得溶液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)化合物A所含有的元素为________;化合物A与H2O反应的离子方程式为:________。
(2)化合物A可由FeCl3和KClO在强碱性条件下制得,其反应的离子方程式为:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com