
| A. | FeS+稀H2SO4 | B. | NaOH+FeCl3 | C. | Cl2+NaOH溶液 | D. | SO2+NaOH |
分析 有离子参加的反应为离子反应,含元素化合价变化的反应为氧化还原反应,以此来解答.
解答 解:A.反应生成硫酸亚铁和硫化氢,为离子反应,但不含元素化合价变化,为非氧化还原反应,故A不选;
B.反应生成氢氧化铁和氯化钠,为离子反应,但不含元素化合价变化,为非氧化还原反应,故B不选;
C.反应生成氯化钠、次氯酸钠和水,为离子反应,且Cl元素的化合价变化,为氧化还原反应,故C选;
D.反应生成亚硫酸钠和水,或生成亚硫酸氢钠,为离子反应,但不含元素化合价变化,为非氧化还原反应,故D不选;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应、元素化合价变化为解答的关键,侧重分析与应用能力的考查,注意化学反应的分类,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | pH=3的NH4Cl溶液中水的电离程度等于pH=11的氨水溶液中水的电离程度 | |
| C. | 已知Ka(HF)=7.2×10-4,Ka(HCN)=6.2×10-10,等体积等浓度的NaF、NaCN溶液中,前者离子总数小于后者 | |
| D. | 将a mol•L-1 CH3COOH溶液与b mol•L-1 NaOH溶液等体积混合,测得溶液pH为7,则a与b的关系:a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 可逆反应 FeCl3(aq)+3KSCN(aq)═Fe(SCN)3(aq)+3KCl(aq) 建立平衡后,在其它条件不变时,加入KC1固体,观察体系颜色的变化. | 验证浓度对化学平衡 的影响 |
| B | 相同温度下,将等质量的大理石块、大理石粉末分别加入等体积、等浓度的盐酸和硫酸中,观察气泡产生的快慢. | 验证固体接触面积对 化学反应速率的影响 |
| C | 相同温度下,两支试管中装有等体积、等浓度的H2O2溶液,向其中分别加入少量FeCl3固体和少量MnO2固体. | 验证不同催化剂对 H2O2分解速率的影响 |
| D | 将S02气体通入溴水中,观察溶液颜色的变化 | 证明S02具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向盐酸中滴加氨水:H++OH-═H2O | |
| B. | 用FeCl3溶液腐蚀铜线路板:2Fe3++Cu═2Fe2++Cu2+ | |
| C. | 硫酸铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+2H2O+4NH4+ | |
| D. | 澄清石灰水与少量小苏打溶液混合:Ca(OH)2+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液中可能大量存在H+、Cl-、MnO4- | |
| B. | pH=2的溶液中可能大量存在Na+、NH4+、SiO32- | |
| C. | 向Ca(HCO3)2溶液中加入少量NaOH溶液的反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 向稀HNO3中滴加Na2SO3溶液的反应:SO32-+2H+═SO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | L电子层的电子数为奇数的所有元素都是非金属元素 | |
| B. | 短周期元素X、Y的原子序数相差2,则X、Y不可能处于同一主族 | |
| C. | 从左至右第8、9、10三列元素中没有非金属元素 | |
| D. | 若M+和R2+的核外电子层结构相同,则可推出原子序数:R>M |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
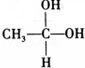 →CH3-CHO+H2O
→CH3-CHO+H2O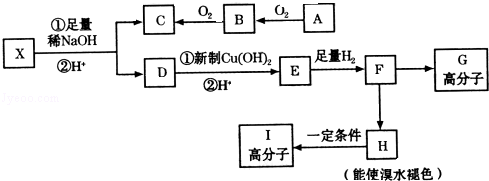
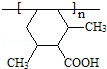 .
.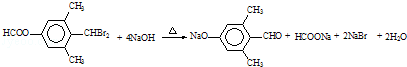 .
.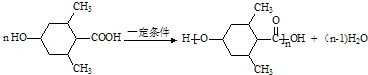 .
.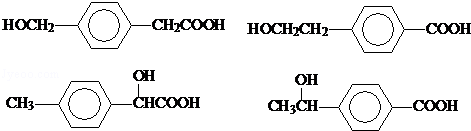 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
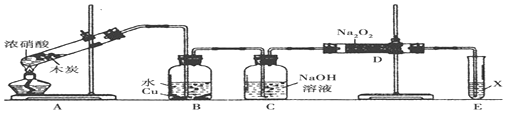
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com