
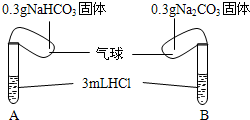
 Ⅰ.化学课上老师演示了如图的实验:
Ⅰ.化学课上老师演示了如图的实验:| 序号 | 试剂1 | 试剂2 | 混合前 温度 | 混合后温度 |
| ① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10ml水 | 20℃ | 24.2℃ |
| ⑤ | 35mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
| 0.3g |
| 84g/mol |
| 0.3g |
| 84g/mol |
| 0.3g |
| 106g/mol |
| 0.3g |
| 106g/mol |
| 0.3g |
| 84g/mol |
| 0.3g |
| 106g/mol |


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案科目:高中化学 来源: 题型:
A、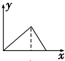 |
B、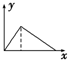 |
C、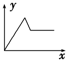 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一部分为Al(OH)3,一部分为Al3+ |
| B、全部为Al(OH)3 |
| C、一部分为Al(OH)3,一部分为AlO2- |
| D、全部为AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
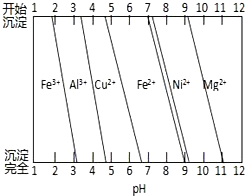 金属材料在人类生产生活中有着重要的应用,但人们使用更多的不是纯金属,而是合金.
金属材料在人类生产生活中有着重要的应用,但人们使用更多的不是纯金属,而是合金.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 解释或实验结论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: (1)A的相对分子质量为: |
| (2)将此9.0g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g | (2)A的分子式为: |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24L CO2 (标准状况),若与足量金属钠反应则生成2.24L H2(标准状况 ) | (3)写出A中含有的官能团: |
(4)A的核磁共振氢谱如图: | (4)A中含有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
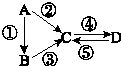 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com