
锂锰电池的体积小,性能优良,是常用的一次电池。该电池反应原理如图
所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,
生成LiMnO2。回答下列问题:
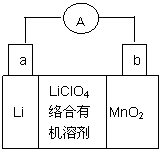 (1)a电极为__________极(填“正”或“负”)。
(1)a电极为__________极(填“正”或“负”)。
(2)电池正极反应式为_______________________。
(3)是否可用水代替电池中的混合有机溶_______
(填“是”或“否”),原因是___________________。
(4)MnO2与双氧水混合化学方程式为 ;
MnO2的作用是 。
(5)MnO2可与KOH和KClO3在高温条件下反应,生
成K2MnO4,反应的化学方程式为_________________________________________,
K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为___________。
 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
下列各项表述正确的是 ( )
A.水分子的结构式是H—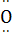 —H
—H
B.NaCl的电子式为N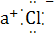
C.23Na37Cl中质子数和中子数之比是7∶8
D.三氟化氮的电子式为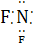 F
F
查看答案和解析>>
科目:高中化学 来源: 题型:
最近科学家在-100 ℃的低温下合成了一种烃X,其核磁共振氢谱表明该分子中的氢原子的化学环境没有区别,根据分析,绘制了如图所示的球棍模型。下列说法中错误的是( )
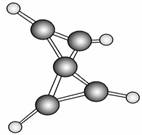 A.烃X的分子式为C5H4
A.烃X的分子式为C5H4
B.分子中碳原子的化学环境有2种
C.该有机物含有官能团
D.X分子中只有碳碳单键,没有碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解一定量的硫酸铜溶液,电解一段时间后,向电解液加入0.1 mol碱式
碳铜晶体(不含结晶水),恰好使溶液恢复到电解前的浓度和pH。下列有关叙述不正确的是
A.电解过程产生的气体体积(在标准状况下)为5.6 L
B.电解过程只发生了2CuSO4+2H2O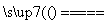 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
C.电解过程转移的电子数为3.612×1023个
D.加入的碱式碳酸铜的反应是:Cu2(OH)2CO3+2H2SO4====2CuSO4+CO2↑+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知如下两个热化学反应方程式。

下列说法不正确的是( )
A.反应①、②都属于加成反应
B.在通常条件下,反应①、②都能自发进行
C.反应①吸热、反应②放热的事实说明苯环中含有的并不是碳碳双键
D.反应①、②中的所有有机物均可使溴水层褪色,但褪色原理不完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
以下有关原子结构及元素周期律的叙述中正确的是
A.同种元素的原子均有相同的质子数和中子数
B.同主族元素的简单阴离子还原性越强,水解程度越大
C.同周期金属元素的化合价越高,其原子失电子能力越强
D.短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ. 乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式:
________________________________________________________________________。
(2)已知:
甲醇脱水反应 2CH3OH(g) === CH3OCH3(g) + H2O(g) △H1 == -23.9 kJ·mol—1
甲醇制烯烃反应 2CH3OH(g) === C2H4(g) + 2H2O(g) △H2 == -29.1 kJ·mol—1
乙醇异构化反应 C2H5OH(g) === CH3OCH3(g) △H3 == + 50.7 kJ·mol—1
则乙烯气相直接水合反应C2H4(g) + H2O(g)=== C2H5OH(g)的△H == __________________________。与间接水合法相比,气相直接水合法的优点是__________________________________。
Ⅱ. 甲醇虽然毒性很强,但它是一种清洁燃料,也是一种重要的合成原料。工业甲醇的质量分数可以用下列方法测定:
①在稀硫酸中甲醇被Cr2O72-氧化成CO2和H2O,其反应为:
CH3OH + Cr2O72— + 8H+ ==== CO2↑+ 2Cr3+ + 6H2O;
②过量的Cr2O72—可用Fe2+与之完全反应,反应如下所示:
____Cr2O72— + ____Fe2+ +____H+ ――― ____Cr3+ +____Fe3+ +____H2O
现有0.12 g工业甲醇,在稀硫酸中与25.0 mL 0.2 mol/L K2Cr2O7溶液反应,多余的K2Cr2O7
恰好与9.6 mL 1.0 mol/L FeSO4溶液完全反应。
(3)请配平第②步中离子方程式(配平系数依次填写在短线上)。
(4)工业甲醇的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,完成以下有关问题。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(1)写出下列元素符号:
① ;⑥ ;⑦ ;⑪ 。
(2)在这些元素中,最活泼的金属元素是 ;最活泼的非金属元素是 ;最不活泼的元素是 。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是 ;碱性最强的是 ;呈两性的氢氧化物是 ;写出三者之间相互反应的化学方程式
;
;
。
(4)在这些元素中,原子半径最小的是 ;原子半径最大的是 。
(5)④和⑧形成的化合物中含有的化学键类型是 ;其电子式为 。
(6)在⑧和⑫中,非金属性较强的是 ;写出能体现非金属性强弱的一个化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的反应,不属于同一反应类型的是
| A | 甲烷和氯气光照制四氯化碳 | 乙酸和乙醇制乙酸乙酯 |
| B | 实验室由乙醇制乙烯 | 乙醇使酸性高锰酸钾溶液褪色 |
| C | 溴丙烷水解制丙醇 | 淀粉制葡萄糖 |
| D | 苯乙烯生成乙基环己烷 | 乙烯使溴的四氯化碳溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com