
| A. | 医用酒精是用淀粉类植物发酵经蒸馏制成,浓度通常是75% | |
| B. | 向海水中加入净水剂明矾可以使海水淡化 | |
| C. | 福尔马林可浸制标本,利用了其使蛋白质变性的性质 | |
| D. | 绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物 |
分析 A.75%的酒精为医用酒精,具有杀菌消毒作用;
B.明矾具有吸附作用,可净化海水,但不能淡化;
C.甲醛可使蛋白质变性;
D.烟花利用金属的焰色反应的性质.
解答 解:A.75%的酒精为医用酒精,可使蛋白质变性,具有杀菌消毒作用,乙醇可由淀粉类植物发酵经蒸馏制成,故A正确;
B.明矾水解生成具有吸附作用的氢氧化铝,除去水中的悬浮物,可净化海水,但不能淡化,故B错误;
C.福尔马林的主要成分为甲醛,甲醛可使蛋白质变性,可用于浸制标本,故C正确;
D.烟花利用金属的焰色反应的性质,故D正确.
故选B.
点评 本题综合考查有机物的结构和性质以及元素化合物知识,为高考常见题型,侧重于化学与生活的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 完全沉淀时的pH值 | 3.2 | 5.2 | 10.4 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+HNO3(浓)→Cu(NO3)2 | B. | Cu+HNO3(稀)→Cu(NO3)2 | ||
| C. | Cu$\stackrel{空气}{→}$CuO$\stackrel{稀硝酸}{→}$Cu(NO3)2 | D. | Cu+AgNO3→Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途.试回答下列问题:
镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成离子键的阴阳离子间只存在静电吸引力 | |
| B. | HF、HCl、HBr、HI的热稳定性和还原性均依次减弱 | |
| C. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 | |
| D. | NH5中的所有原子的最外层都符合相应稀有气体原子电子层结构,1molNH5中含有4NA个N-H键(NA表示阿伏加德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰醋酸与食用醋有相同的气味 | |
| B. | 乙烯、氯乙烯、苯乙烯都可用于合成有机高分子材料 | |
| C. | 苯能与溴发生反应,因此不能用苯萃取溴水中的溴 | |
| D. | 淀粉和纤维素水解的最终产物都是葡萄糖,因此二者互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
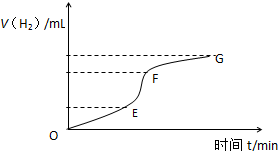 用纯净的锌粒与稀盐酸反应制取氢气,请回答:
用纯净的锌粒与稀盐酸反应制取氢气,请回答:| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com