
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1 |
分析 A.甲烷的燃烧热指1molCH4完全燃烧生成稳定氧化物时放出的热量;
B.将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)的物质的量小于1mol;
C.中和热是指在稀溶液中,强酸和强碱反应生成1mol水时放出的热量;
D.2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则2mol氢气燃烧放出571.6 kJ热量.
解答 解:A.甲烷的燃烧热指1molCH4完全燃烧生成稳定氧化物时放出的热量,焓变与计量数成正比,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ•mol-1,故A错误;
B.将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)的物质的量小于1mol,而方程式中表示N2(g)与H2(g)完全反应生成2molNH3(g)放出的热量,故B错误;
C.中和热是指在稀溶液中,强酸和强碱反应生成1mol水时放出的热量,其衡量标准是生成的水为1mol,故无论稀H2SO4和Ca(OH)2反应生成的水是几摩尔,其中和热恒为57.3KJ/mol;故C错误;
D.2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则2mol氢气燃烧放出571.6 kJ热量,则氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1,故D正确.
故选D.
点评 本题考查了燃烧热、中和热以及热化学方程式中计量数的含义,难度不大,注意把握中和热和燃烧热的概念以及可逆反应的特点,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 分子式 | 外观 | 沸点 |
| 高氯酸 | HClO4 | 无色液体 | 130℃ |
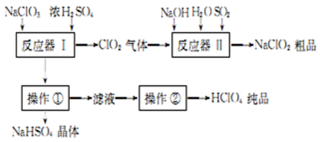
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
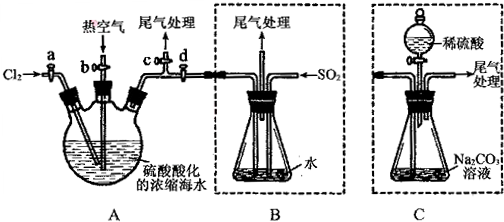
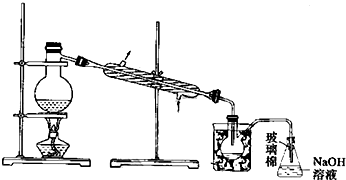
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率是指一定时间内任何一种反应物的物质的量的减少或任何一种生成物物质的量的增加 | |
| B. | 化学反应速率为0.8mol•L-1•s-1是指1秒钟时某物质的浓度为0.8mol•L-1 | |
| C. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| D. | 对于任何化学反应来说,反应速率越快,反应现象就越明显 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积不变,向其中加入1mol H2 | |
| B. | 体积不变,向其中加入1mol N2 | |
| C. | 压强不变,向其中加入1mol N2 | |
| D. | 压强不变,向其中加入1mol H2和1molI2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
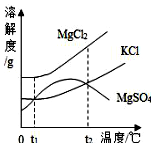 海洋资源开发前景十分广阔.海水晒盐能够得到粗盐和卤水,卤水中含有MgCl2、KCl和MgSO4等物质,图是它们的溶解度曲线.则下列说法不正确的是( )
海洋资源开发前景十分广阔.海水晒盐能够得到粗盐和卤水,卤水中含有MgCl2、KCl和MgSO4等物质,图是它们的溶解度曲线.则下列说法不正确的是( )| A. | t1℃时,三种物质的饱和溶液中,溶质质量分数最大的是MgCl2 | |
| B. | t1℃时,分别在100g水中溶解了等质量的MgCl2、KCl,两溶液都可达到饱和 | |
| C. | t2℃时,KCl和MgSO4两种物质的溶解度相同 | |
| D. | 将卤水加热到t2℃以上,析出的晶体主要为MgSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com