
| A. | 体现浓硫酸的吸水性 | |
| B. | 体现了浓硫酸的脱水性 | |
| C. | 体现了浓硫酸的吸水性和脱水性 | |
| D. | 体现了浓硫酸的吸水性、脱水性和强氧化性 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
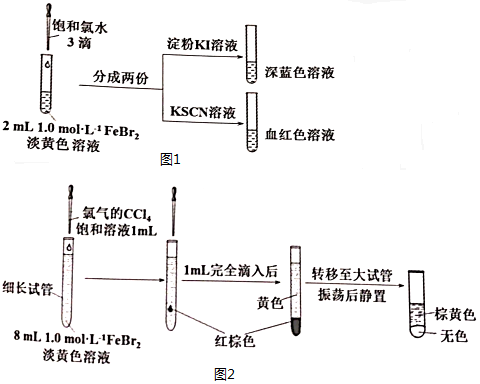
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
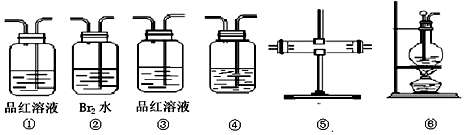
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数(25℃) | Ka=1.77 ×10-4 | Ka=4.0 ×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红热的铜丝在硫蒸汽中燃烧,产生黑色固体 | |
| B. | 碘水中加入少量CCl4,振荡静置后,下层颜色变浅,上层颜色变为紫色 | |
| C. | 往溴水中加入碘化钠溶液,溴水变为无色 | |
| D. | 氢气在Cl2中燃烧产生白色的烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘和干冰的升华 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 氯化钠和铁的熔化 | D. | 金刚石和氯化钾的熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、Br-、SO42- | B. | Na+、Ba2+、ClO-、Cl- | ||
| C. | Ca2+、Cl-、HCO3-、K+ | D. | NH4+、K+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 编号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 乙烷(乙烯) | 溴的四氯化碳溶液 | 洗气 |
| B | 硝基苯(硝酸) | H2O | 过滤 |
| C | 溴苯(溴) | NaOH溶液 | 分液 |
| D | 乙烯(SO2) | NaOH溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
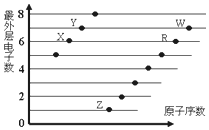
| A. | X与W形成的化合物中只有共价键 | B. | X与Z形成的化合物中只有离子键 | ||
| C. | 元素的非金属性:X>R>W | D. | 简单离子的半径:W>R>X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com