


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
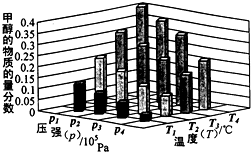 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.查看答案和解析>>
科目:高中化学 来源: 题型:
对于热方程式说法正确的是:
A.中和热ΔH=-57.3 kJ·mol-1,, 则2H+(aq)+![]() (aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) △H=-114.6 kJ·mol-1
(aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) △H=-114.6 kJ·mol-1
B.将0.5 molN2和1.5 mol H2于密闭容器生成NH3(g),放热19.3 kJ,方程式为:
N2(g)+3H2(g) ![]() 2NH3(g) △H=—38.6 kJ·mol—1
2NH3(g) △H=—38.6 kJ·mol—1
C. 标准状况:H2(g)+F2(g) ===2HF(g) △H=-270kJ/mol,
D.氨氧化:4NH3(g)+5O2(g) ===4NO(g)+6H2O(g) △H=-1025 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省葫芦岛一高高二上学期第一次月考化学试卷(带解析) 题型:单选题
对于热方程式说法正确的是:
A.中和热ΔH=-57.3 kJ·mol-1,, 则2H+(aq)+ (aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) △H=-114.6 kJ·mol-1 (aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) △H=-114.6 kJ·mol-1 |
| B.将0.5 molN2和1.5 mol H2于密闭容器生成NH3(g),放热19.3 kJ,方程式为: N2(g)+3H2(g)  2NH3(g)△H="—38.6" kJ·mol—1 2NH3(g)△H="—38.6" kJ·mol—1 |
| C.标准状况:H2(g)+F2(g) ==="2HF(g)" △H=-270kJ/mol, |
| D.氨氧化:4NH3(g)+5O2(g) ===4NO(g)+6H2O(g)△H=-1025 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com