
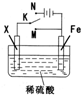
| A、若X为碳棒,开关K置于M处,则溶液中的H+移向Fe极 |
| B、若X为碳棒,开关K置于N处,转移0.2mol e-时析出0.1mol O2 |
| C、若X为铜棒,开关K置于M或N处,均可减缓铁的腐蚀 |
| D、若X为锌棒,开关K置于M或N处,锌电极上反应均为Zn-2e-=Zn2+ |


科目:高中化学 来源: 题型:

| A、图-1:a为电源正极 |
| B、图-1:辅助电极上的反应:O2+4e+2H2O→4OH- |
| C、图-2:电子流动方向d→c |
| D、图-2:金属A可以是耐腐蚀的金属铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
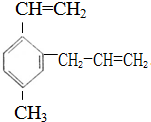 .下列说法中不正确的是( )
.下列说法中不正确的是( )| A、该有机物使溴的四氯化碳溶液褪色和在FeCl3作用下与液溴反应的原理一样 |
| B、1mol该有机物完全燃烧需消耗15.5mol O2 |
| C、该有机物在一定条件下与浓HNO3反应生成的一硝基代物可能有3种 |
| D、1mol该有机物在一定条件下最多能与5mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2、O2和NO的物质的量浓度相等 |
| B、反应体系中的压强不随时间变化 |
| C、N2、O2、NO三种物质同时存在 |
| D、单位时间内生成1mol N2 同时消耗1mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | Na2CO3 | NaClO | NaHCO3 | NaHSO3 |
| pH | 11.6 | 10.3 | 9.7 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com