
| 时间/min | 0 | 10 | 20 | 40 | 50 | |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
| A. | T1时0~10 min NO2的平均反应速率为0.15 mol•L-1•min-1 | |
| B. | T2时CH4的平衡转化率为70.0% | |
| C. | 保持其他条件不变,T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),平衡向正反应方向移动 | |
| D. | 保持其他条件不变,T1时向平衡体系中再充入0.50 mol CH4和1.20 mol NO2,与原平衡相比,达新平衡时N2的浓度增大 |
分析 A.结合v=$\frac{△c}{△t}$及速率之比等于化学计量数之比计算;
B.由表格数据可知,T2时CH4的平衡物质的量为0.15mol,则转化的甲烷为0.50mol-0.15mol=0.35mol;
C.T1时,体积为1L,由表格中数据可知,
CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)
开始 0.5 1.2 0 0 0
转化 0.4 0.8 0.4 0.4 0.8
平衡 0.1 0.4 0.4 0.4 0.8
K=$\frac{0.4×0.4×0.{8}^{2}}{0.1×0.{4}^{2}}$=6.4,
T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),比较Qc、K,判断反应进行方向;
D.体积不变,物质的量变为原来的2倍,若平衡不移动,则平衡浓度变为原平衡的2倍,但压强增大平衡逆向移动.
解答 解:A.T1时0~10 min CH4的平均反应速率为$\frac{0.15mol/L}{10min}$=0.015 mol•L-1•min-1,由速率之比等于化学计量数之比可知,T1时0~10 min NO2的平均反应速率为0.03 mol•L-1•min-1,故A错误;
B.由表格数据可知,T2时CH4的平衡物质的量为0.15mol,则转化的甲烷为0.50mol-0.15mol=0.35mol,则T2时CH4的平衡转化率为$\frac{0.35}{0.5}$×100%=70.0%,故B正确;
C.T1时,体积为1L,由表格中数据可知,
CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)
开始 0.5 1.2 0 0 0
转化 0.4 0.8 0.4 0.4 0.8
平衡 0.1 0.4 0.4 0.4 0.8
K=$\frac{0.4×0.4×0.{8}^{2}}{0.1×0.{4}^{2}}$=6.4,
T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),Qc=$\frac{0.4×0.4×1.6{\;}^{2}}{0.1×0.{4}^{2}}$=25.6>K,则平衡逆向移动,故C错误;
D.体积不变,物质的量变为原来的2倍,若平衡不移动,则平衡浓度变为原平衡的2倍,但压强增大平衡逆向移动,则达新平衡时N2的浓度增大,大于原平衡浓度小于原平衡浓度的2倍,故D正确;
故选BD.
点评 本题考查化学平衡的计算,为高频考点,把握表格中数据、平衡三段法、Qc与K的计算为解答的关键,侧重分析与计算能力的考查,注意选项C为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:解答题
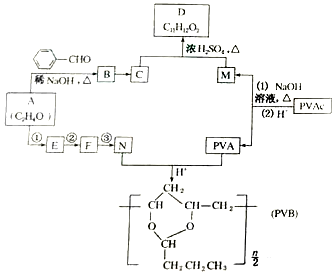
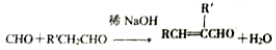 (R、R′表示烃基或氢)
(R、R′表示烃基或氢)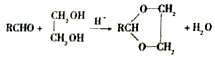
 合成B的化学方程式是
合成B的化学方程式是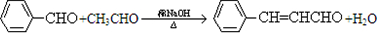 .
.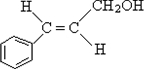 .
.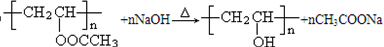 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 起始(mL) | 终点(mL) | |
| 1 | 5.00 | 20.02 |
| 2 | 3.00 | 18.00 |
| 3 | 4.00 | 18.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节.回答下列问题:
氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
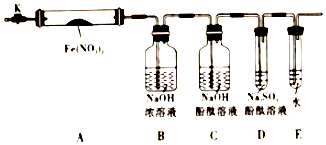 固体硝酸盐加热易分解且产物较复杂,某学习小组以Fe(NO3)2为研究对象,通过实验探究其热分解的产物,查阅资料,根据硝酸盐受热分解的规律,提出如下4种猜想:
固体硝酸盐加热易分解且产物较复杂,某学习小组以Fe(NO3)2为研究对象,通过实验探究其热分解的产物,查阅资料,根据硝酸盐受热分解的规律,提出如下4种猜想:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com