
| A. | 向Na2S03溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀出现,说明Na2S03溶液已经变质 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB | |
| D. | 向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明KSP[Cu(OH)2]>KSP[Mg(OH)2] |
分析 A.亚硫酸钠易被酸性氧化生成硫酸钠;
B.作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护;
C.等体积、pH都为3的酸HA和HB分别与足量的锌反应,生成氢气越多的酸其酸性越弱;
D.溶度积常数小的物质先沉淀.
解答 解:A.亚硫酸钠易被酸性氧化生成硫酸钠,干扰硫酸根离子的检验,应该用稀盐酸酸化,故A错误;
B.作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护,Zn、Fe和海水构成的原电池中,Fe作正极被保护,故B正确;
C.等体积、pH都为3的酸HA和HB分别与足量的锌反应,生成氢气越多的酸其酸性越弱HA放出的氢气多,说明酸性:HA<HB,故C错误;
D.溶度积常数小的物质先沉淀,则向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明KSP[Cu(OH)2]<KSP[Mg(OH)2],故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及物质检验、原电池原理、酸的强弱判断、溶度积常数等知识点,明确物质性质、实验原理是解本题关键,注意:物质检验时要排除其它物质的干扰,易错选项是A.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
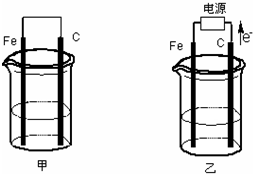 甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属冶炼和金属化合物处理常涉及氧化还原反应.
金属冶炼和金属化合物处理常涉及氧化还原反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑥⑦ | B. | ①②⑦ | C. | ①④⑤⑥ | D. | ①④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2、N2O4混合气体加压,颜色先变深后变浅,比原来深 | |
| B. | H2(g)+I2(g)?2HI(g),加压混合气体颜色加深 | |
| C. | 饱和氯水光照后颜色变浅 | |
| D. | 碳酸钠、酚酞的混合溶液加热颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com