
【题目】在298 K、101 kPa下,将22 g CO2通入750 mL 1 mol·L-1 NaOH溶液中充分反应,测得反应放出x kJ热量。已知该条件下,1 mol CO2通入1 L 2 mol·L-1 NaOH溶液中充分反应放出y kJ热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式为( )
A. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2y-x) kJ·mol-1
B. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=(4x-y) kJ·mol-1
C. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1
D. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=(2y-x) kJ·mol-1
【答案】C
【解析】
根据题意,22gCO2通入750mL 1molL-1NaOH溶液中充分反应,n(CO2)=![]() =0.5mol,n(NaOH)=1molL-1×0.75L=0.75mol,该反应既生成碳酸钠又生成碳酸氢钠,方程式为2CO2+3NaOH═NaHCO3+Na2CO3+H2O,由0.5molCO2反应放出热量为xkJ,则2molCO2反应放出热量为4xkJ,即热化学反应方程式为2CO2(g)+3NaOH(aq)═NaHCO3(aq)+Na2CO3(aq)+H2O(l) △H=-4xkJ/mol①,又1mol CO2通入1L 2molL-1NaOH溶液中充分反应放出y kJ的热量,则热化学方程式为2NaOH(aq)+CO2(g)═Na2CO3(aq)+H2O(l) △H=-ykJ/mol②,由盖斯定律可知,①-②可得,NaOH(aq)+CO2(g)═NaHCO3(aq) △H=-(4x-y)kJ/mol,故选C。
=0.5mol,n(NaOH)=1molL-1×0.75L=0.75mol,该反应既生成碳酸钠又生成碳酸氢钠,方程式为2CO2+3NaOH═NaHCO3+Na2CO3+H2O,由0.5molCO2反应放出热量为xkJ,则2molCO2反应放出热量为4xkJ,即热化学反应方程式为2CO2(g)+3NaOH(aq)═NaHCO3(aq)+Na2CO3(aq)+H2O(l) △H=-4xkJ/mol①,又1mol CO2通入1L 2molL-1NaOH溶液中充分反应放出y kJ的热量,则热化学方程式为2NaOH(aq)+CO2(g)═Na2CO3(aq)+H2O(l) △H=-ykJ/mol②,由盖斯定律可知,①-②可得,NaOH(aq)+CO2(g)═NaHCO3(aq) △H=-(4x-y)kJ/mol,故选C。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】随着环境污染的加重和人们环保意识的加强,生物降解材料逐渐受到了人们的关注。以下是PBA (—种生物降解聚酯高分子材料)的合成路线:

己知:①烃A的相对分子质量为84,核磁共振氢谱显示只有1组峰,不能使溴的四氯化碳溶液褪色。
②化合物C中只含一个官能团。
③R1CH=CHR2![]() R1COOH+R2COOH
R1COOH+R2COOH
④
(1)由A生成B的反应类型为_________。
(2)由B生成C的化学方程式为__________。
(3)E的结构简式为______________________。
(4)F的名称为______________(用系统命名法);由D和生成PBA的化学方程式为_______________;若PBA的平均聚合度为70,则其平均相对分子质量为___________。
(5)E的同分异构体中能同时满足下列条件的共有_____种(不含立体异构)。
①链状化合物 ②能发生银镜反应 ③氧原子不与碳碳双键直接相连
其中,核磁共振氢谱显示为2组峰,且峰面积比为2:1的是_________(写结构简式)。
(6)若由1.3—丁二烯为原料(其他无机试剂任选)通过三步制备化合物F,其合成路线为:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100 0 mol·L-1的盐酸滴定20.00 mL未知浓度的氨水,滴定曲线如图所示,滴加20.00 mL盐酸时所得溶液中c(Cl-)=c(NH4+)+c(NH3·H2O)+c(NH3)。下列说法错误的是

A. 该氨水的浓度为0.100 0 mol·L-1
B. 点①溶液中c(NH4+)+c(NH3·H2O)+c(NH3)=2c(Cl-)
C. 点②溶液中c(NH4+)=c(Cl-)
D. 点③溶液中c(Cl-)>c(H+)>c(NH4+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
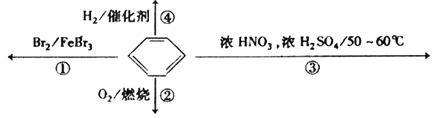
A. 反应![]() 为取代反应,有机产物的密度比水小
为取代反应,有机产物的密度比水小
B. 反应![]() 为取代反应,有机产物是一种烃
为取代反应,有机产物是一种烃
C. 反应![]() 中1mol苯最多与
中1mol苯最多与![]() 发生加成反应,是因为苯分子含有三个碳碳双键
发生加成反应,是因为苯分子含有三个碳碳双键
D. 反应![]() 为氧化反应,反应现象是火焰明亮并带有较多的黑烟
为氧化反应,反应现象是火焰明亮并带有较多的黑烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。工业上,利用乙烯水化法制乙醇:CH2=CH2+H2O![]() CH3CH2OH。下列有关说法正确的是
CH3CH2OH。下列有关说法正确的是
A. 1mol乙烯和1mol乙醇分别完全燃烧,消耗O2的分子数均为3NA
B. 1mol H2O和H2F+的混合物中所含质子数为10NA
C. 乙醇催化氧化生成1mol乙醛时转移电子数为NA
D. 46g乙醇中所含共价键的数目为7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素a、b、c、d、e的原子序数依次增大,b是地壳中含量最高的元素,e的单质的熔点在同周期元素中最高,a、b的原子序数之和等于e的原子序数,d原子的核外电子层数等于最外层电子数:分别向cdb2溶液、c2eb3溶液中通入气体ab2,产生沉淀的质量与通入气体的体积的定性关系都可用右图表示。下列说法不正确的是
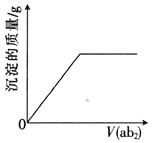
A. 原子半径:c>d>e>a>b
B. 工业上通常采用ab高温还原d2b3的方法冶炼d的单质
C. 同温下,0.1mol·L-1c2eb3溶液的pH大于0.1mol·L-1c2ab3溶液
D. 简单氢化物的热稳定性:b>a>e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL1.00mol·L-1HCl溶液和V2mL未如浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )

A. 做该实验时环境温度为22℃ B. 该实验表明化学能可以转化为热能
C. NaOH溶液的浓度约为1.00mol·L-1 D. 该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其合金在生活、生产中有广泛应用。
(1)最新研究表明:氢氧化铝溶于氢氧化钠溶液中生成Na[Al(OH)4]。则氢氧化铝在水中发生酸式电离的电离方程式为________________________________。
(2)目前,国内对真空碳热还原-氯化法冶炼铝的研究较多,利用该方法冶炼金属铝,既节能又环保。
已知:①Al2O3(s)+AlCl3(g)+3C(s)=====3AlCl(g)+3CO(g) △H1
②3AlCl(g)====2Al(l)+AlCl3(g) △H2
③Al(l)====Al(s) △H3
则Al2O3(s)+3C(s)====2Al(s)+3CO(g) △H4=___________(用含△H1、△H2、△H3的代数式表示)。
(3)已知:Al4C3是真空碳热还原-氯化法冶炼铝的中间产物,它与水反应生成气体Y,Y是含氢量最大的烃。向2L恒容密闭容器中充入2mol Y和2mol水蒸气,一定条件下发生反应a Y(g)+bH2O(g) ![]() c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
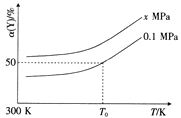
①上述反应的△H_______0(填“>”“<”或“=”)。
②图象中,x_________0.1(填“>”“<”或“=”)。
③在T0K、0.1MPa时,上述反应的平衡常数K=____________。
④提高上述反应的反应速率的措施有_______________________________ (任填二项)。
⑤从上述反应体系中分离出H2(还含有少量CO)作为合成氨的原料气,为避免CO使催化剂中毒,原料气在通入合成塔之前需与适量NH3混合,并用[Cu(NH3)2]Ac溶液吸收CO,反应原理为[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g) ![]() [Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
[Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
(4)我国首创的海水电池以铝板为负极,以接触空气的铁铂合金网为正极,以弱碱性的海水为电解质溶液,电池总反应为4Al+3O2+6H2O===4Al(OH)3。试写出海水电池的正极反应式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g) ![]() 3C(g)+5D(g)的反应中,表示该反应速率最快的是
3C(g)+5D(g)的反应中,表示该反应速率最快的是
A. v (D)= 4.0 mol/(L·s)B. v (C)=3.2mol/(L·s)
C. v (A)= 2.0mol/(L·s)D. v (B)= 1.2mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com