
某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH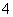 、Cl-、CO
、Cl-、CO 、SO
、SO ,现分别取100 mL的两等份溶液进行如下实验:
,现分别取100 mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02 mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2生成白色沉淀,沉淀经过滤、洗涤、干燥、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65 g固体。
依据实验回答下列问题:
(1)综合以上实验,该混合物的水溶液中一定不存在的离子是 (填离子符号)。
(2)写出②中产生沉淀的离子方程式 。
(3)某同学通过分析认为该溶液中K+一定 (填“存在”或“不存在”),他的理由是 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)  2NH3(g) ΔH= -92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖。在密闭容器中,使2 mol N2和6 mol H2混合发生上述反应,达到平衡:
2NH3(g) ΔH= -92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖。在密闭容器中,使2 mol N2和6 mol H2混合发生上述反应,达到平衡:
(1)此时,N2和H2的浓度比是 ;N2和H2的转化率比是 。
(2)若恒容下升高温度,则混合气体的相对分子质量 ;
密度 。(填“变大”“变小”或“不变”)。
(3)若充入氩气,并保持压强不变,平衡将 ;(填“正向”“逆向”或“不”)移动。
(4)若容器恒容、绝热, 加热使容器内温度迅速升至原来的2倍,达到新平衡后,
容器内温度 (填“大于”“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
在1L密闭容器中,把l mol A和1 mol B混合发生如下反应:3A(g) + B(g)  XC(g) + 2D(g)。当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,则下列叙述不正确的是
XC(g) + 2D(g)。当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,则下列叙述不正确的是
A.x的值为2 B.A的转化率为40%
C.B的平衡浓度为0.8 mol/L D.达到平衡时D的体积分数为20%
查看答案和解析>>
科目:高中化学 来源: 题型:
以下物质间的每步转化,不能通过一步反应实现的是( )
A.S→SO2→H2SO4→MgSO4 B.Si→SiO2→Na2SiO3→H2SiO3
C.Al→Al2O3→Al(OH)3→NaAlO2 D.N2→NO→NO2→HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
已知离子方程式:As2S3+H2O+NO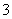 —→AsO
—→AsO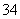 +SO
+SO +NO↑+________
+NO↑+________  (未配平),(已知:As2S3 中As的化合价为+3)则下列说法错误的是( )
(未配平),(已知:As2S3 中As的化合价为+3)则下列说法错误的是( )
A.配平后水的化学计量数为4 B.反应后溶液呈酸性
C.配平后氧化剂与还原剂的物质的量之比为3∶28 D.氧化产物为AsO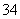 和SO
和SO
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述正确的是( )
A.放热反应的反应速率总是大于吸热反应的反应速率
B.已知一定条件下石墨转化为金刚石吸收热量,则石墨比金刚石稳定
C.对于吸热反应,生成物总能量一定低于反应物总能量
D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电化学装置的说法正确的是( )
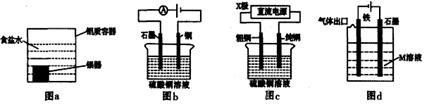
A.利用图a装置处理银器表面的黑斑Ag2S,银器表面发生的反应为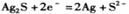
B.图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C.图c中的X极若为负极,则该装置可实现粗铜的精炼
D.图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。
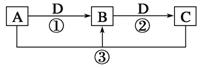
请回答下列问题:
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是__________;工业上制取A的离子方程式_________________________。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为____________________________________。
(3)若D是氯碱工业的主要产品之一,B有两性,则反应②的离子方程式是________________________________________________________________。
(4)若A、C、D都是常见气体,C是导致酸雨的主要气体,则反应③的化学方程式为_________________________________________________________。
某同学将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因: _____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
锎是锕系中的一种元素,1 mg锎( Cf)每秒钟约能释放出2.34×109个中子,在医学上常用作治疗恶性肿瘤的中子源。下列有关说法错误的是( )
Cf)每秒钟约能释放出2.34×109个中子,在医学上常用作治疗恶性肿瘤的中子源。下列有关说法错误的是( )
A.锎位于元素周期表第6周期
B.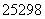 Cf和
Cf和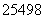 Cf互为同位素
Cf互为同位素
C.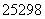 Cf中,质子数和电子数均为98
Cf中,质子数和电子数均为98
D.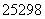 Cf的中子数与质子数之差为56
Cf的中子数与质子数之差为56
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com