
| c(NaOH)×V(NaOH) |
| c(H+) |
| 0.1mol/L×0.0246L |
| 0.025L |
| c(NaOH)×V(NaOH) |
| c(H+) |


科目:高中化学 来源: 题型:
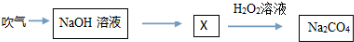
| A、Na2CO4是一种盐,其中碳为+6价 |
| B、X溶液中可能含两种盐 |
| C、该过程中没有发生氧化还原反应 |
| D、NaHCO3与盐酸和氢氧化钠均能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
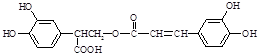
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、NaHCO3溶液和少量Ba(OH)2溶液混合:HCO3-+OH-+Ba2+═H2O+BaCO3↓ |
| C、NaHCO3溶液和过量Ba(OH)2溶液混合:2HCO3-+2OH-+Ba2+═BaCO3↓+2H2O+CO32- |
| D、NaAlO2溶液中通入少量CO2:2A1O2-+CO2+3H2O═2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
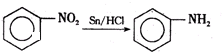

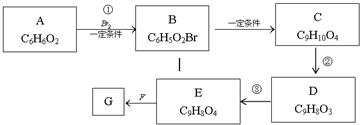
 ,物质E含2个六元环.
,物质E含2个六元环.查看答案和解析>>
科目:高中化学 来源: 题型:

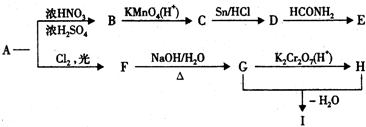
查看答案和解析>>
科目:高中化学 来源: 题型:
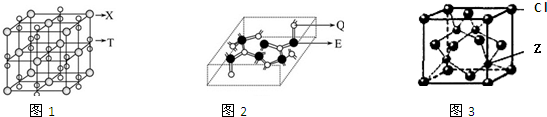
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如图所示的装置.
某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如图所示的装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com