
| A. | CH2=CH2+HCl$→_{△}^{催化剂}$CH3CH2Cl | |
| B. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | |
| C. | 2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH | |
| D. | CH3CH2Br+NaOH$\stackrel{乙醇}{→}$CH2=CH2↑+NaBr+H2O |
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:选择题
| A. | XY2 | B. | X2Y3 | C. | X2Y | D. | XY |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | Al | B | Be | C | Cl | X | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
| 元素 | Mg | N | Y | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
 、该物质中的化学键为离子键、共价键.
、该物质中的化学键为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷. 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
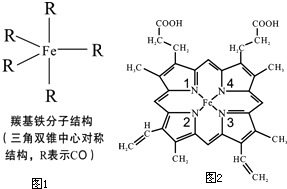 Fe、C、N、O、H可以组成多种物质.回答以下问题:
Fe、C、N、O、H可以组成多种物质.回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com