
°æƒø°øµ™ «…˙√¸ŒÔ÷ µƒ÷ÿ“™◊È≥…‘™Àÿ÷Æ“ª£¨∫¨µ™ŒÔ÷ ”λÀ¿ýµƒ…˙ªÓ√Ы–œýπÿ£Æ
£®1£©µ™‘≠◊”◊ÓÕ‚≤„µÁ◊”≈≈≤º ΩŒ™£∫£ªµ™¿Î◊”£®N3©Å£©∫ÀÕ‚”–÷÷‘À∂Ø◊¥Ã¨≤ªÕ¨µƒµÁ◊”£ªN4∑÷◊”µƒø’º‰Ω·ππ»ÁÕº£∫ ![]() £¨À¸ «“ª÷÷∑÷◊”£Æ£®ÃÓ°∞º´–‘°±ªÚ°∞∑«º´–‘°±£©
£¨À¸ «“ª÷÷∑÷◊”£Æ£®ÃÓ°∞º´–‘°±ªÚ°∞∑«º´–‘°±£©
£®2£©∞±∆¯ «»Àπ§πõ™µƒ≤˙ŒÔ£¨À¸º´“◊»Ð”⁄ÀÆ£®1£∫700£©£¨…˙≥…NH3H2O£Æ«Î…˺∆ µ—È÷§√˜NH3H2O «»ıºÓ £Æ
£®3£©œÚ100mL 0.1mol/Lµƒ—ŒÀ·÷–Õ®»Î0.02mol∞±∆¯£¨≥‰∑÷Œ¸ ’∫Û≤‚µ√»Ð“∫≥ ºÓ–‘£Æ‘Ú∏√»Ð“∫÷–NH3H2O°¢NH4+°¢Cl©Å»˝÷÷Œ¢¡£µƒŒÔ÷ µƒ¡ø≈®∂»¥Û–°πÿœµŒ™ £Æ
£®4£©Ôß—Œø…”√◊˜µ™∑ £¨ µ—È “ºÏ—ÈÔß—Œ÷–µƒNH4+ ±£¨ø…»°…Ÿ¡øÔß—Œ—˘∆∑”⁄ ‘πÐ÷–£¨º”»Î«øºÓ≈®»Ð“∫£¨º”»»£¨»Ù≤˙…˙µƒ∆¯ÃÂƒÐ π £¨ Àµ√˜”–NH4+ £Æ
£®5£©NaN3ø…”√”⁄÷∆‘Ï∆˚≥µ∞≤»´∆¯ƒ“£¨µ±∆˚≥µ”ˆµΩ◊≤ª˜ ±£¨NaN3ƒÐ—∏ÀŸ∑÷Ω‚≤˙…˙Na∫ÕN2 £Æ «Î–¥≥ˆ∏√∑¥”¶µƒªØ—ß∑Ω≥Ã Ω £¨ √ø…˙≥…3mol N2 ±£¨◊™“∆µÁ◊”mol£Æ
°æ¥∞∏°ø
£®1£©2s22p3£ª10£ª∑«º´–‘
£®2£©»°…Ÿ¡ø∞±ÀÆ”⁄ ‘πÐ÷–,µŒº”∑”Ù ‘“∫,»Ð“∫≥ ∫Ï…´£ªœÚ ‘πÐ÷–º”»Î…Ÿ¡ø¥◊À·ÔßæßÃÂ,’Òµ¥,”…”⁄Ôß∏˘¿Î◊”≈®∂»‘ˆ¥Û,‘ڻГ∫÷–«‚—ı∏˘¿Î◊”≈®∂»ºı–°,‘ڻГ∫µƒ∫Ï…´±‰«≥,÷§√˜∞±ÀÆ «»ıºÓ
£®3£©NH4+£æCl©Å£æNH3?H2O
£®4£© ™»Ûµƒ∫Ï…´ Ø»Ô ‘÷Ω±‰¿∂
£®5£©2NaN3![]() 2Na+3N2£ª2
2Na+3N2£ª2
°æΩ‚Œˆ°øΩ‚£∫£®1£©µ™‘≠◊”Œ™7∫≈‘™Àÿ”–¡Ω∏ˆµÁ◊”≤„£¨◊ÓÕ‚≤„5∏ˆµÁ◊”£¨æð¥À È–¥◊ÓÕ‚≤„µÁ◊”≈≈≤º ΩŒ™£∫2s22p3£ªµ™¿Î◊”£®N3©Å£©◊ÓÕ‚≤„8∏ˆµÁ◊”£¨Ω·∫œ∫ÀÕ‚µÁ◊”≈≈≤º∑÷Œˆ‘À∂Ø◊¥Ã¨≤ªÕ¨µƒµÁ◊”£¨‘≠◊”∫ÀÕ‚√ª”–¡Ω∏ˆ‘À∂Ø◊¥Ã¨ÕÍ»´œýÕ¨µƒµÁ◊”£¨”–º∏∏ˆµÁ◊”æÕ”–º∏÷÷‘À∂Ø◊¥Ã¨£¨µ™¿Î◊”£®N3©Å£©∫ÀÕ‚”– 10÷÷‘À∂Ø◊¥Ã¨≤ªÕ¨µƒµÁ◊”£¨N4∑÷◊””ÎP4Ω·ππœýÀ∆£¨Œ™’˝Àƒ√ÊÃÂππ–Õ£¨N4∑÷◊”÷–N‘≠◊”–Œ≥…3∏ˆ¶“º¸°¢∫¨”–1∂‘π¬∂‘µÁ◊”£¨‘”ªØπϵ¿ ˝ƒøŒ™4£¨√ø∏ˆ√ÊŒ™’˝»˝Ω«–Œ£¨Œ™∑«º´–‘∑÷◊”£¨
À˘“‘¥∞∏ «£∫2s22p3£ª10£ª∑«º´–‘£ª£®2£©»Ù÷§√˜“ªÀÆ∫œ∞±‘⁄ÀƻГ∫¿Ô≤ø∑÷µÁ¿Î£¨‘ÚÀµ√˜“ªÀÆ∫œ∞± «»ıµÁΩ‚÷ £¨
À˘“‘—°”√ ‘º¡Œ™£∫∑”Ù°¢¥◊À·Ôß°¢“ªÀÆ∫œ∞±£¨
≤Ÿ◊˜∑Ω∑®º∞œ÷œÛŒ™£∫»°…Ÿ¡ø∞±ÀÆ”⁄ ‘πÐ÷–£¨µŒº”∑”Ù ‘“∫£¨»Ð“∫≥ ∫Ï…´£ªœÚ ‘πÐ÷–º”»Î…Ÿ¡ø¥◊À·Ôßæß㨒ҵ¥£¨”…”⁄Ôß∏˘¿Î◊”≈®∂»‘ˆ¥Û£¨‘ڻГ∫÷–«‚—ı∏˘¿Î◊”≈®∂»ºı–°£¨‘ڻГ∫µƒ∫Ï…´±‰«≥£¨∏˘æðœ÷œÛø…÷™£∫∞±ÀÆ÷–¥Ê‘⁄µÁ¿Î∆Ω∫‚£¨÷§√˜∞±ÀÆ «»ıºÓ£¨
À˘“‘¥∞∏ «£∫»°…Ÿ¡ø∞±ÀÆ”⁄ ‘πÐ÷–£¨µŒº”∑”Ù ‘“∫£¨»Ð“∫≥ ∫Ï…´£ªœÚ ‘πÐ÷–º”»Î…Ÿ¡ø¥◊À·Ôßæß㨒ҵ¥£¨”…”⁄Ôß∏˘¿Î◊”≈®∂»‘ˆ¥Û£¨‘ڻГ∫÷–«‚—ı∏˘¿Î◊”≈®∂»ºı–°£¨‘ڻГ∫µƒ∫Ï…´±‰«≥£¨÷§√˜∞±ÀÆ «»ıºÓ£ª£®3£©œÚ100mL 0.1mol/Lµƒ—ŒÀ·÷–Õ®»Î0.02mol∞±∆¯£¨∑¢…˙∑¥”¶…˙≥…¬»ªØÔߣ¨µ√µΩµ»≈®∂»µƒNH3H2O∫ÕNH4ClªÏ∫œ»Ð“∫£¨≥‰∑÷Œ¸ ’∫Û≤‚µ√»Ð“∫≥ ºÓ–‘£¨“ªÀÆ∫œ∞±µÁ¿Î¥Û”⁄Ôß∏˘¿Î◊”ÀÆΩ‚£¨»Ð“∫÷–NH3H2O°¢NH4+°¢Cl©Å»˝÷÷Œ¢¡£µƒŒÔ÷ µƒ¡ø≈®∂»¥Û–°πÿœµŒ™£∫NH4+£æCl©Å£æNH3H2O£¨
À˘“‘¥∞∏ «£∫NH4+£æCl©Å£æNH3H2O£ª£®4£©Ôß—Œ”κÓ∑¥”¶…˙≥…∞±∆¯£¨∂¯∞±∆¯ «Œ®“ªµƒºÓ–‘∆¯Ã£¨ƒÐ π ™»Ûµƒ∫Ï…´ Ø»Ô ‘÷Ω±‰¿∂£¨π œÚƒ≥»Ð“∫º”»ÎNaOH≤¢Œ¢»»£¨≤˙…˙ƒÐπª π ™»Ûµƒ∫Ï…´ Ø»Ô ‘÷Ω±‰¿∂µƒŒÞ…´∆¯Ã£¨º¥∏√∆¯ÃÂŒ™∞±∆¯£¨‘Ú∏√»Ð“∫÷–“ª∂®∫¨”–NH4+£¨
À˘“‘¥∞∏ «£∫ ™»Ûµƒ∫Ï…´ Ø»Ô ‘÷Ω±‰¿∂£ª£®5£©µ˛µ™ªØƒ∆£®NaN3£©◊≤ª˜∫Û30∫¡√΃⁄—∏ÀŸ∑÷Ω‚Œ™¡Ω÷÷µ•÷ £¨”…÷ ¡ø ÿ∫„∂®¬…£¨∑¥”¶«∞∫Û‘™Àÿ÷÷¿ý≤ª±‰£¨¡Ω÷÷µ•÷ Œ™ƒ∆∫Õµ™∆¯£¨∑¥”¶µƒªØ—ß∑Ω≥Ã ΩŒ™£∫2NaN3 ![]() 2Na+3N2£¨…˙≥…3molN2µÁ◊”◊™“∆2mol£¨
2Na+3N2£¨…˙≥…3molN2µÁ◊”◊™“∆2mol£¨
À˘“‘¥∞∏ «£∫2NaN3 ![]() 2Na+3N2£ª2£Æ
2Na+3N2£ª2£Æ
°æøºµ„æ´Œˆ°ø±æÂ÷˜“™øº≤È¡Àµ™◊‘™ÀÿºÚΩȵƒœýπÿ÷™ ∂µ„£¨–Ë“™’∆Œ’‘≠◊”Ω·ππÃÿµ„œýÕ¨µ„£∫◊ÓÕ‚≤„µÁ◊” ˝æ˘Œ™5∏ˆ≤ªÕ¨µ„£∫µÁ◊”≤„ ˝≤ªÕ¨≤≈ƒÐ’˝»∑Ω‚¥¥À£Æ



| ƒÍº∂ | ∏þ÷–øŒ≥à | ƒÍº∂ | ≥ı÷–øŒ≥à |
| ∏þ“ª | ∏þ“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı“ª | ≥ı“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ∂˛ | ∏þ∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı∂˛ | ≥ı∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ»˝ | ∏þ»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı»˝ | ≥ı»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° |
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø¿˚”√ªØ—ß‘≠¿Ìø…“‘∂‘π§≥ß≈≈∑≈µƒ∑œÀÆ°¢∑œ‘¸µ»Ω¯––”––ߺÏ≤‚£Æƒ≥π§≥ß∂‘÷∆∏ı𧓵Œ€ƒý÷–Cr£®¢Û£©ªÿ ’”ΑŸ¿˚”√𧓒»Áœ¬£®¡ÚÀ·Ω˛“∫÷–Ω Ù¿Î◊”÷˜“™ «Cr3+ £¨ ∆‰¥Œ «Fe3+ £¨ Fe2+ £¨ Al3+ £¨ Ca2+ £¨ Mg2+£© 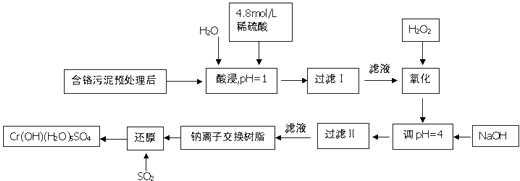
≥£Œ¬œ¬≤ø∑÷—Ù¿Î◊”µƒ«‚—ıªØŒÔ–Œ≥…≥¡µÌ ±»Ð“∫µƒpHº˚œ¬±Ì£∫
—Ù¿Î◊” | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
ø™ º≥¡µÌ ±µƒpH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | ©Å |
≥¡µÌÕÍ»´ ±µƒpH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0£®£æ9.0»ÐΩ‚£© |
£®1£©À·Ω˛ ±£¨Œ™¡À÷∏þΩ˛»°¬ ø…≤…»°µƒ¥Î © «£®÷¡…Ÿ“ªÃı£©
£®2£©µ˜pH=4.0 «Œ™¡À≥˝»•£®ÃÓFe3+ £¨ Al3+ £¨ Ca2+ £¨ Mg2+£©
£®3£©ƒ∆¿Î◊”Ωªªª ˜÷¨µƒ‘≠¿ÌŒ™Mn++n NaR°˙MRn+nNa+ £¨ ±ªΩªªªµƒ‘”÷ ¿Î◊” «£®ÃÓFe3+ £¨ Al3+ £¨ Ca2+ £¨ Mg2+£©
£®4£© ‘≈‰∆Ωœ¬¡–—ıªØªπ‘≠∑¥”¶∑Ω≥Ã Ω£∫Na2Cr2O7+SO2+H2O=Cr£®OH£©£®H2O£©5SO4+Na2SO4 £Æ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øœ¬Õº «œÚMgCl2°¢AlCl3ªÏ∫œ»Ð“∫÷–£¨ø™ ºµŒº”7 mL ‘º¡A£¨÷Æ∫Û∏ƒµŒº” ‘º¡B£¨À˘µ√≥¡µÌŒÔ÷ µƒ¡øy (mol) ”Î ‘º¡Ãª˝V(mL)º‰µƒπÿœµ»ÁÕºÀ˘ æ°£( ‘º¡A°¢B∑÷± «NaOH »Ð“∫—ŒÀ·÷–µƒ“ª÷÷)
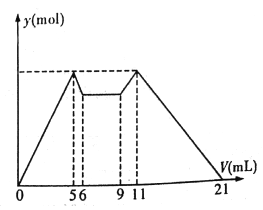
“‘œ¬Ω·¬€≤ª’˝»∑µƒ «
A. A «NaOH »Ð“∫£¨B «—ŒÀ·
B. ‘≠ªÏ∫œ“∫÷–£¨c(Al3+) :c(Mg2+) :c(Cl-)=1:1:5
C. c(NaOH) :c(HCl)=1:2
D. ¥”6 µΩ9 µƒπ˝≥Ã÷–£¨∑¢…˙µƒ∑¥”¶µƒ¿Î◊”∑¥”¶∑Ω≥Ã Ω «H+ +OH-=H2O
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øÕºŒ™±Ω∫Չµƒ»°¥˙∑¥”¶µƒ µ—È◊∞÷√Õº£¨∆‰÷–AŒ™”…æþ”–÷ßπеƒ ‘πÐ÷∆≥…µƒ∑¥”¶»ð∆˜£¨‘⁄∆‰œ¬∂Àø™¡À“ª∏ˆ–°ø◊£¨»˚∫√ Ø√Þ»Þ£¨‘Ÿº”»Î…Ÿ¡øÃ˙–º∑€£Æ 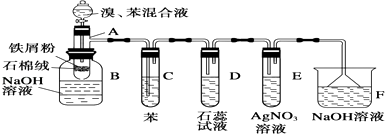
ÃÓ–¥œ¬¡–ø’∞◊£∫
£®1£©œÚ∑¥”¶»ð∆˜A÷–÷µŒº”»Î‰Â∫Õ±ΩµƒªÏ∫œ“∫£¨º∏√Î÷”ƒ⁄æÕ∑¢…˙∑¥”¶£Æ–¥≥ˆA÷–À˘∑¢…˙∑¥”¶µƒªØ—ß∑Ω≥Ã Ω£®”–ª˙ŒÔ–¥Ω·ππºÚ Ω£©£∫ £Æ
£®2£© ‘πÐC÷–±Ωµƒ◊˜”√ « £Æ ∑¥”¶ø™ º∫Û£¨π€≤ÏD∫ÕE¡Ω ‘πУ¨ø¥µΩµƒœ÷œÛŒ™ £Æ
£®3£©∑¥”¶2°´3min∫Û£¨‘⁄B÷–µƒNaOH»Ð“∫¿Ôø…π€≤ÏµΩµƒœ÷œÛ « £Æ
£®4£©‘⁄…œ ˆ’˚Ã◊◊∞÷√÷–£¨æþ”–∑¿µπŒ¸◊˜”√µƒ“«∆˜”–£®ÃÓ◊÷ƒ∏£©£Æ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øœ¬¡–∑÷◊”÷–À˘”–ú‘≠◊”øœ∂®≤ª‘⁄Õ¨“ª∆Ω√Ê…œµƒ «£® £©
A.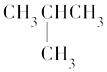
B.CH3CH=CHCH3
C.CH2=CHCH2CH3
D.![]()
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø¬»ªØºÿ»Ð“∫≥£”√◊˜¿˚ƒÚº¡º∞∑¿÷Œ»±ºÿ÷¢µƒ“©ŒÔ£¨ƒ≥“Ω¡∆ µ—È–°◊È–Ë“™”√µΩ480 mLŒÔ÷ µƒ¡ø≈®∂»Œ™0.5 mol°§L£≠1µƒ¬»ªØºÿ»Ð“∫°£ªÿ¥œ¬¡–Œ £∫
£®1£©≈‰÷∆∏√»Ð“∫£¨–Ë≥∆¡ø¬»ªØºÿæßõƒ÷ ¡ø «________°£
£®2£©≈‰÷∆…œ ˆ¬»ªØºÿ»Ð“∫£¨–Ë“™ π”√µƒ≤£¡ß“«∆˜ «¡øÕ≤°¢…’±≠°¢≤£¡ß∞Ù°¢________°¢________°£
£®3£©»ÁÕº¢Ò±Ì æ10 mL¡øÕ≤÷–“∫√ʵƒŒª÷√£¨øÃ∂»A”ÎB£¨B”ÎCº‰æ˘œý≤Ó1 mL£¨»Áπ˚øÃ∂»AŒ™9£¨‘Ú¡øÕ≤÷–“∫õƒÃª˝ «________mL°£
£®4£©∂®»ð ±£¨ƒ≥Õ¨—ß≤Ÿ◊˜ æ“‚Õº»ÁÕº¢ÚÀ˘ 棨‘Ú∆‰À˘≈‰¬»ªØºÿ»Ð“∫µƒ≈®∂»________(ÃÓ°∞¥Û”⁄°±°∞µ»”⁄°±ªÚ°∞–°”⁄°±)0.5 mol°§L£≠1£ªƒ≥Õ¨—ß”…”⁄≤Ÿ◊˜≤ª…˜£¨∂®»ð ±µº÷¬“∫√Ê∏þ”⁄øÃ∂»œþ£¨À˚¡¢º¥”√Ω∫Õ∑µŒπÐΩ´“∫ÃÂŒ¸≥ˆ£¨ π“∫√Ê«°∫√¥ÔµΩøÃ∂»œþ£¨«Îƒ„∆¿º€∏√Õ¨—ßµƒ◊ˆ∑®£∫__________°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø“—÷™Aµƒ≤˙¡øø…“‘”√¿¥∫‚¡ø“ª∏ˆπ˙º“ ؔժØπ§∑¢’πÀÆ∆Ω£Æ£¨B°¢C°¢D°¢E°¢Fæ˘Œ™≥£º˚µƒ”–ª˙ŒÔ£¨‘⁄“ª∂®Ãıº˛œ¬£¨À¸√«”–»ÁÕºÀ˘ 浃◊™ªØπÿœµ£Æ 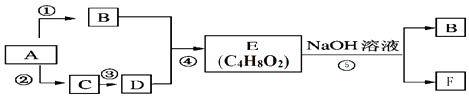
£®1£©a£Æ‘ÚAµƒµÁ◊” ΩŒ™£∫ b£ÆƒÐ”ÎΩ Ùƒ∆∑¥”¶∑≈≥ˆ«‚∆¯µƒŒÔ÷ ”–£®ÃÓ◊÷ƒ∏£©
c£Æ«Î È–¥∑¥”¶¢Ðµƒ∑Ω≥Ã Ω£∫
£®2£©ƒ≥Ã˛Mœý∂‘∑÷◊”÷ ¡øŒ™140£¨∆‰÷–úµƒ÷ ¡ø∑÷ ˝Œ™0.857£ÆM∑÷◊”÷–”–¡Ω∏ˆÃº‘≠◊”≤ª”Ϋ‚‘≠◊”÷±Ω”œý¡¨£ÆA‘⁄“ª∂®Ãıº˛œ¬—ıªØ÷ª…˙≥…G£¨GƒÐ π Ø»Ô ‘“∫±‰∫ϣƓ—÷™ 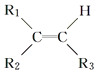
![]()
 +R3COOH
+R3COOH
‘–¥≥ˆ£∫ªØ∫œŒÔA∫ÕGµƒΩ·ππºÚ Ω£¨A£∫G£∫ £Æ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øµ™µƒµ•÷ º∞∆‰ªØ∫œŒÔ–‘÷ ∂ý—˘£¨”√Õæπ„∑∫£Æ ÕÍ≥…œ¬¡–ÃÓø’£Æ
£®1£©ø∆—ߺ“’˝‘⁄—–æø¿˚”√¥þªØºº ıΩ´≥¨“ÙÀŸ∑…ª˙Œ≤∆¯÷–µƒNO∫ÕCO◊™±‰≥…CO2∫ÕN2£∫2NO+2CO ![]() 2CO2+N2+Q£®Q£æ0£© ƒ≥Œ¬∂»œ¬≤‚µ√∏√∑¥”¶‘⁄≤ªÕ¨ ±º‰µƒCO≈®∂»»Á±Ì£∫
2CO2+N2+Q£®Q£æ0£© ƒ≥Œ¬∂»œ¬≤‚µ√∏√∑¥”¶‘⁄≤ªÕ¨ ±º‰µƒCO≈®∂»»Á±Ì£∫
±º‰£®s£© | 0 | 1 | 2 | 3 | 4 | 5 |
c£®CO£© | 3.60°¡10©Å3 | 3.05°¡10©Å3 | 2.85°¡10©Å3 | 2.75°¡10©Å3 | 2.70°¡10©Å3 | 2.70°¡10©Å3 |
∏√∑¥”¶∆Ω∫‚≥£ ˝Kµƒ±Ì¥Ô ΩŒ™£ªŒ¬∂»…˝∏þ£¨K÷µ£®—°ÃÓ°∞‘ˆ¥Û°±°¢°∞ºı–°°±°¢°∞≤ª±‰°±£©£ª«∞2sƒ⁄µƒ∆Ωæ˘∑¥”¶ÀŸ¬ v£®N2£©=£ª»Ù…œ ˆ∑¥”¶‘⁄√б’»ð∆˜÷–∑¢…˙£¨¥ÔµΩ∆Ω∫‚ ±ƒÐ÷∏þNO◊™ªØ¬ µƒ¥Î ©÷Æ“ª « £Æ
£®2£©π§“µ∫œ≥…∞±µƒ∑¥”¶Œ¬∂»—°‘Ò500°Ê◊Û”“µƒ‘≠“Ú « £Æ
£®3£© µ—È “‘⁄πÃ∂®»ðª˝µƒ√б’»ð∆˜÷–º”»Î1molµ™∆¯∫Õ3mol«‚∆¯ƒ£ƒ‚𧓵∫œ≥…∞±£¨∑¥”¶‘⁄“ª∂®Ãıº˛œ¬“—¥ÔµΩ∆Ω∫‚µƒ±Í÷æ « £Æ a£ÆN2°¢H2°¢NH3µƒ≈®∂»÷Ʊ»Œ™1£∫3£∫2
b£Æ»ð∆˜ƒ⁄µƒ—π«ø±£≥÷≤ª±‰
c£ÆN2°¢H2°¢NH3µƒ≈®∂»≤ª‘Ÿ∑¢…˙±‰ªØ
d£Æ∑¥”¶Õ£÷𣨒˝°¢ƒÊ∑¥”¶µƒÀŸ¬ ∂ºµ»”⁄¡„
£®4£©≥£Œ¬œ¬œÚ∫¨1mol»Ð÷ µƒœ°—ŒÀ·÷–ª∫ª∫Õ®»Î1mol NH3£®»Ð“∫ê˝±‰ªØ∫ˆ¬‘≤ªº∆£©£¨∑¥”¶Ω· ¯∫ۻГ∫÷–¿Î◊”≈®∂»”…¥ÛµΩ–°µƒÀ≥–Ú «£ª‘⁄Õ®»ÎNH3µƒπ˝≥Ã÷–»Ð“∫µƒµºµÁƒÐ¡¶£®—°ÃÓ°∞±‰¥Û°±°¢°∞±‰–°°±°¢°∞º∏∫ı≤ª±‰°±£©£Æ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øƒ≥Ω Ù¬»ªØŒÔMCl2÷ ¡øŒ™møÀ£¨∫¨”–0.4molCl-,‘ÚΩ ÙMµƒƒ¶∂˚÷ ¡øø…±Ì 挙£® £©
A. (m+71) g/mol B. 5m g/mol C. (5m-71) g/mol D. (5m-35.5) g/mol
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
∞Ÿ∂»÷¬–≈ - ¡∑œ∞≤·¡–±Ì - ‘¡–±Ì
∫˛±± °ª•¡™Õ¯Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®∆Ωî | Õ¯…œ”–∫¶–≈œ¢æŸ±®◊®«¯ | µÁ–≈’©∆≠柱®◊®«¯ | …Ê¿˙ ∑–ÈŒÞ÷˜“”–∫¶–≈œ¢æŸ±®◊®«¯ | …Ê∆Û«÷»®æŸ±®◊®«¯
Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®µÁª∞£∫027-86699610 柱®” œ‰£∫58377363@163.com