
 提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。
提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。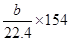 kJ·mol-1;
kJ·mol-1;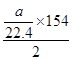 =154a/44.8kJ·mol-1;
=154a/44.8kJ·mol-1;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.反应的热化学方程式:2H2(g)+O2(g)=2H2O(g) ΔH= +483.6 kJ·mol?1 |
| B.氢气的燃烧热为241.8 kJ·mol?1 |
| C.1 mol H2O(1)的能量大于1 mol H2O(g)的能量 |
| D.2 mol H2和1 mol O2的能量总和大于2 mol H2O(g)的能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
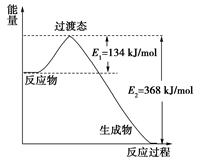
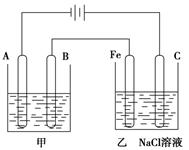
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 TiCl4
TiCl4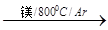 Ti
Ti | A.DH3 +2DH1-2DH2 | B.DH3 +DH1-DH2 |
| C.DH3 +2DH1-DH2 | D.DH3 +DH1-2DH2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.已知2H2(g)+O2(g) |
| B.由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定 |
C.X(g)+Y(g) Z(g)+W(s)△H>0,恒温恒容条件下达到平衡后加入X, Z(g)+W(s)△H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大 |
| D.已知C(s)+O2(g)=CO2(g)△H1 , C(s)+1/2O2(g)=CO(g)△H2, |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲同学:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解吸热 |
B.乙同学:用加热的 方法可除去KNO3溶液中混有的Fe3+,说明含Fe3+的盐水解吸热 方法可除去KNO3溶液中混有的Fe3+,说明含Fe3+的盐水解吸热 |
| C.丙同学:通过实验发现同浓度的热的纯碱液比冷的纯碱液去油污效果好,说明碳酸钠水解吸热 |
| D.丁同学:在纯碱液中滴入酚酞试液,加热(不考虑水蒸发)后若红色加深,说明碳酸钠水解吸热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com