
| A. | 苯酚能跟浓溴水反应而乙醇不能 | |
| B. | 乙炔能发生加成反应而乙烷不能 | |
| C. | 钠与乙醇反应缓慢而与水反应剧烈 | |
| D. | 苯在50℃~60℃时发生硝化反应而甲苯在30℃时即可 |
分析 A.苯酚中酚-OH影响苯环,苯环上H易被取代;
B.乙炔含碳碳三键,乙烷为饱和烃;
C.乙醇、水中-OH连接基团不同;
D.甲苯中甲基影响苯环,苯环上H易被取代.
解答 解:A.苯酚、乙醇均含-OH,苯酚中酚-OH影响苯环,苯环上H易被取代,则苯酚易与溴水发生取代反应,而乙醇不能,与有机物分子内基团间的相互作用有关,故A不选;
B.乙炔含碳碳三键,乙烷为饱和烃,则乙炔发生加成反应,而乙烷不能,与官能团有关,故B选;
C.乙醇、水中-OH连接基团不同,则乙醇与Na反应缓慢,与有机物分子内基团间的相互作用有关,故C不选;
D.苯、甲苯均不含官能团,甲苯中甲基影响苯环,苯环上H易被取代,则甲苯易发生硝化反应,与有机物分子内基团间的相互作用有关,故D不选;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意官能团与性质、基团相互影响的判断,题目难度中等.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④⑥ | C. | ①②⑤ | D. | ①②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Cu═2FeCl2+CuCl2
现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Cu═2FeCl2+CuCl2查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2O═H++OH- | B. | NaHSO4═Na++HSO4- | ||
| C. | NaHS═Na++HS- | D. | HCO3-═H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | Na+ | Mg2+ | Ca2+ | K+ | Li+ | Cl- | SO42- | Br- |
| 含量/mg•L-1 | 9965 | 1200 | 400 | 380 | 0.17 | 19350 | 1200 | 67 |
| 实验操作 | 实验现象 |
| Ⅰ.取1mL海水,加入1mL0.1mol/L的NaOH溶液 | 有白色沉淀 |
| Ⅱ.取1mLCaCl2溶液,加入1mL0.1mol/L的NaOH溶液 | 无白色沉淀 |


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用电子式表示HCl的形成过程: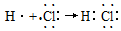 | |
| B. | ${\;}_{87}^{166}$Ho中的原子核内的中子数与核外电子数之差是99 | |
| C. | 在空气中加热金属锂:4Li+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Li2O | |
| D. | Na2O2与H2O2中所含的化学键类型不完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓ | |
| B. | 图乙中Cr2O72-向惰性电极移动,与该极附近的OH-结合,转化成Cr(OH)3除去 | |
| C. | 图乙电解池中,若有0.84 g阳极材料参与反应,则阴极会有168 mL(标准状况)的气体产生 | |
| D. | 若图甲燃料电池消耗0.36 g镁产生的电量用以图乙废水处理,理论上可产生1.07g氢氧化铁沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com