
��10�֣�������һ����Ҫ�� ����ԭ�ϣ���ҵ�������������Ҫ�������£�
����ԭ�ϣ���ҵ�������������Ҫ�������£�
��1����N2��H2Ϊԭ�Ϻϳɰ�����һ���¶��£����ܱ������г���ImolN2��3molH2������Ӧ���������ݻ��㶨���ﵽƽ��״̬ʱ������������ʵ�����ԭ����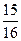 ����N2��ת����
����N2��ת����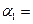 ��������ѹǿ�㶨���ﵽƽ��״̬ʱ��N=��ת����Ϊ
��������ѹǿ�㶨���ﵽƽ��״̬ʱ��N=��ת����Ϊ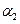 ����
����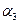
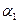 �����>������<����=������
�����>������<����=������
��2���ð������������������ᣬ���������̿ɱ�ʾΪ��
4NH3+5O2 4NO+6H2O 4NO+3O2+2H2O=4HNO3
4NO+6H2O 4NO+3O2+2H2O=4HNO3
����3.4��Һ��Ϊԭ����������������Ϊ50%�����ᣬ��������Ҫ��ˮ������Ϊ
�֡����������������з�Ӧ��������������ģ�
��3�����Ṥҵ�����е�β�����ô�����Һ���գ��йصĻ�ѧ��ӦΪ��
2NO2+Na2CO3=NaNO2+NaNO3+CO2,NO+NO2+Na2CO3=2NaNO2+CO2�����ڱ�״������NO��NO2�Ļ�����壨������N2O4��ǡ����50mL 1�� 0 mol��L-1��Na2CO3��Һ��Ӧ��ȫ��������NaNO2��NaNO3�����ʵ����ı�Ϊ4��1�����ڻ��������NO������������Ϊ����?����д��������̣�
0 mol��L-1��Na2CO3��Һ��Ӧ��ȫ��������NaNO2��NaNO3�����ʵ����ı�Ϊ4��1�����ڻ��������NO������������Ϊ����?����д��������̣�
��1��12��5����1��8��>��4�֣�ÿ��2�֣� ��2��9��3�֣�
��2���������ɷ�Ӧ4NH3+5O2
NH3+2O2=HNO3+H2O��3.4��Һ������������Ϊ12.6�֣�ˮΪ3.6�֣������������ˮ������ΪΪ��126.t/50%-(12.6+3.6)t=9t
��3����3�֣��ɷ�Ӧת����ϵ֪����Ӧ��������Ԫ�� �غ㣬��NaNO2��NaNO3�����ʵ����ֱ�Ϊ4a mol��a mol����4a+a=50mL��10-3mL��L-1��1��0 mol��L-1��2����ã�a=0��02 mol�����ǣ��Ƴ�NO��NO2�����ʵ�������Ϊ��0��03 mol��0��07 mol������NO��ռ���������Ϊ30����
�غ㣬��NaNO2��NaNO3�����ʵ����ֱ�Ϊ4a mol��a mol����4a+a=50mL��10-3mL��L-1��1��0 mol��L-1��2����ã�a=0��02 mol�����ǣ��Ƴ�NO��NO2�����ʵ�������Ϊ��0��03 mol��0��07 mol������NO��ռ���������Ϊ30����
����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��һ�������������Ժ�CO2������Ӧ��Fe��s��+CO2��g��
��һ�������������Ժ�CO2������Ӧ��Fe��s��+CO2��g�� FeO��s��+CO��g������H��0
FeO��s��+CO��g������H��0| c(CO) | c(CO2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ���� |
| ||
| ���� |
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| �� |
| ||
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 15 | 16 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com