
NA为阿伏伽德罗常数,下列叙述错误的是
A.常温常压下,42g乙烯和丁烯混合气体中,极性键数为 6 NA
B.1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2 NA个电子
C.由CO2和O2组成的混合气体中共有NA个分子,其中的氧原子数为2NA
D.6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2 NA
 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
将0.23 mol SO2和0.11 mol氧气放入容积为1 L的密闭容器中,发生反应
2SO2+O2 2SO3,在一定温度下,反应达到平衡,得到0.12 mol SO3,则反应的平衡常数K=
2SO3,在一定温度下,反应达到平衡,得到0.12 mol SO3,则反应的平衡常数K=
______________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO2的平衡浓度__________(填“增
大”“不变”或“减小”),氧气的转化率________(填“升高”“不变”或“降低”),SO3的体积分数________(填“增
大”“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是________。
a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2 mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
【提出假设】
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag。
【设计实验方案,验证假设】
(2)甲同学从上述实验的生成物中检验出Fe2+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式:
________________________________________________________________________。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容
(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ① | |
| ② | |
| …… | 若银镜消失,假设2成立。 |
| 若银镜不消失,假设2不成立。 |
【思考与交流】
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立,则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO3-都氧化了Ag。
你是否同意丙同学的结论,并简述理由:
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,对于可逆反应X(g)+3Y(g) 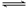 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3mol·L-1、0.08 mol·L-1,则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3mol·L-1、0.08 mol·L-1,则下列判断正确的是
A.c1∶c2=3∶1
B.X、Y的转化率不相等
C.平衡时,Y和Z的生成速率之比为2∶3
D.c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
SiCl4在室温下为无色液体,易挥发,有强烈的刺激性。把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅。一定条件下,在20L恒容密闭容器中发生SiCl4转化为SiHCl3 的反应:3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g) ΔH=Q kJ·mol-1。2 min后达到平衡,H2与SiHCl3的物质的量浓度分别为0.1 mol·L-1和0.2 mol·L-1。
4SiHCl3(g) ΔH=Q kJ·mol-1。2 min后达到平衡,H2与SiHCl3的物质的量浓度分别为0.1 mol·L-1和0.2 mol·L-1。
(1)从反应开始到平衡,v(SiCl4)= 。
(2)该反应的平衡常数表达式为K= ,温度升高,K值增大,则Q 0(填“>”、“<”或“=”)。
 (3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),当反应再次达到平衡时,与原平衡相比较,H2的体积分数将 (填“增大”、“减小”或“不变”)。
(3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),当反应再次达到平衡时,与原平衡相比较,H2的体积分数将 (填“增大”、“减小”或“不变”)。
(4)原容器中,通入H2的体积(标准状况下)为 。
(5)平衡后,将容器的体积缩为10 L,再次达到平衡时,
H2的物质的量浓度范围为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数。下列说法正确的是( )
A.标准状况下,11.2L乙烯含有的极性共价键数为NA
B.常温下,5.6LNO和5.6LO2的混合气体中含有的分子数为0.5NA
C.16.9gBaO2固体中阴、阳离子总数为0.2NA
D.含有1molFe(OH)3的氢氧化铁胶体中含有胶粒数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的数值。下列说法正确的是
A. 0.1 mol·L-1的NaF溶液中所含F-的数目小于0.1NA
B. 标准状况下,2.24L乙醇中含有的C—H键数目为0.5NA
C. 0.1 molNa完全被氧化生成Na2O2,转移电子的数目为0.1NA
D. 0.1 molO3中含氧原子数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
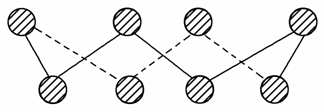
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题。
(1)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是________。
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为________。
(3)Se原子序数为____________,其核外M层电子的排布式为________。
(4)H2Se的酸性比H2S________(填“强”或“弱”)。气态SeO3分子的立体构型为__________,SO 的立体构型为________。
的立体构型为________。
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:________________________________________;
②H2SeO4比H2SeO3酸性强的原因:__________________________ ______________。
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为540.0 pm,密度为______g·cm-3(列式并计算),a位置S2-与b位置Zn2+之间的距离为______pm(列式表示)。
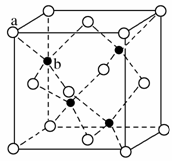
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示。下列叙述中正确的是 ( )
A.反应的化学方程式为5YX
B.t1时,Y的浓度是X浓度的1.5倍
C.t2时,正、逆反应速率相等
D.t3时,逆反应速率大于正反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com