
【题目】科学家分析,地球原始大气中的COS(羰基硫)对氨基酸缩合形成多肽的反应有催化作用,对生命起源起到重要作用。
(1)写出COS的电子式________,C与O形成共价键时,共用电子对会偏向____原子,判断依据是___________。
(2)已知 COS(g)+ H2O(g)![]() H2S(g)+ CO2(g) ΔH1 = - 34kJ/mol
H2S(g)+ CO2(g) ΔH1 = - 34kJ/mol
CO(g)+ H2O(g)![]() H2(g)+ CO2(g) ΔH2 = - 41kJ/mol
H2(g)+ CO2(g) ΔH2 = - 41kJ/mol
写出H2S与CO反应生成 COS 的热化学方程式:_________;100℃ 时将CO与H2S按物质的量比为 1:1 充入反应器中,达平衡后CO的转化率α = 33.3%,此时反应的平衡常数K =______。
(3)在充有催化剂的恒压密闭容器中进行反应。 设起始充入的 n(CO):n(H2S)=m,相同时间内测得H2S转化率与m和温度(T)的关系如图所示。

①m1________m2。(填“ > ”、“ < ”或“ = ”)
②温度高于 T0时,H2S 转化率减小的可能原因为________。
A 反应停止了
B 反应的 ΔH 变大
C 反应达到平衡
D 催化剂活性降低
【答案】![]() O(氧) C与O同周期,核电荷数O>C,原子半径O<C,非金属性O>C CO(g)+H2S(g)
O(氧) C与O同周期,核电荷数O>C,原子半径O<C,非金属性O>C CO(g)+H2S(g)![]() COS(g)+H2(g) △H=-7 kJ/mol 0.25 > c d
COS(g)+H2(g) △H=-7 kJ/mol 0.25 > c d
【解析】
(1)COS分子中碳原子与氧原子、硫原子分别形成两对共用电子对,电子式为![]() ;相同非金属原子之间形成的共价键为非极性共价键,共用电子对不偏向任何一方,不同原子之间形成的为极性共价键,共用电子偏向吸引电子能力强的一方,根据非金属性同周期从左到右非金属性增强,即非金属性C<O,可知共用电子对会偏向氧原子,故答案为:
;相同非金属原子之间形成的共价键为非极性共价键,共用电子对不偏向任何一方,不同原子之间形成的为极性共价键,共用电子偏向吸引电子能力强的一方,根据非金属性同周期从左到右非金属性增强,即非金属性C<O,可知共用电子对会偏向氧原子,故答案为:![]() ;O(氧);C与O同周期,核电荷数O>C,原子半径O<C,非金属性O>C;
;O(氧);C与O同周期,核电荷数O>C,原子半径O<C,非金属性O>C;
(2)已知①COS(g)+ H2O(g)![]() H2S(g)+ CO2(g)ΔH1 = - 34kJ/mol
H2S(g)+ CO2(g)ΔH1 = - 34kJ/mol
②CO(g)+ H2O(g)![]() H2(g)+ CO2(g)ΔH2 = - 41kJ/mol
H2(g)+ CO2(g)ΔH2 = - 41kJ/mol
根据盖斯定律,②-①可得:CO(g)+H2S(g)![]() COS(g)+H2(g) △H=ΔH2-ΔH1= (- 41kJ/mol)-(- 34kJ/mol)=-7 kJ/mol;
COS(g)+H2(g) △H=ΔH2-ΔH1= (- 41kJ/mol)-(- 34kJ/mol)=-7 kJ/mol;
100℃ 时将 CO 与 H2S 按物质的量比为 1:1 充入反应器中,列三段式:
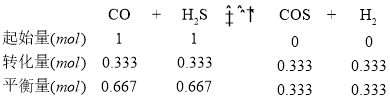
K=![]() =0.25
=0.25
故答案为:CO(g)+H2S(g)![]() COS(g)+H2(g) △H3=-7 kJ/mol;0.25;
COS(g)+H2(g) △H3=-7 kJ/mol;0.25;
(3)①在充有催化剂的恒压密闭容器中进行反应,设起始充入的 n(CO):n(H2S)= m,m越大说明充入的CO越多,两种反应物增加一种会提高另一种的转化率,则m1>m2,故答案为:>;
②图为相同时间内测得 H2S 转化率与 m 和温度(T)的关系,即若平衡逆向移动,或者反应速率变慢可能会使H2S 转化率减小,
A. 可逆反应处于动态平衡,反应并未停止,故A错误;
B. ΔH只与反应物和生成物的总量有关,所以ΔH不会变大,故B错误;
C.温度升高反应达到平衡状态,因为该反应为放热反应,升高温度,平衡逆向移动,所以会使H2S 转化率减小,故C正确;
D.温度升高可能会使催化剂的活性减弱,反应减慢,使H2S 转化率减小,故D正确;
综上所述,答案为CD。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】铬是一种银白色的金属,常用于金属加工、电镀等。工业以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬及获得强氧化剂Na2Cr2O7。其工艺流程如图所示:

已知:高温氧化时发生反应Fe(CrO2)2+Na2CO3+O2→Na2CrO4+Fe2O3+CO2(未配平)
回答下列问题:
(1)将铬铁矿的主要成分Fe(CrO2)2写成氧化物的形式:__,高温氧化时可以提高反应速率的方法为___(写出一条即可)。
(2)Na2CrO4加入硫酸酸化的离子方程式为__;在实验室中,操作a所用到的玻璃仪器有__。
(3)Na2CrO4中铬元素化合价为__;生成1molNa2CrO4时共转移电子的物质的量为__mol。
(4)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol·L-1以下才能排放,可采用加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入硫酸处理多余的Ba2+的方法处理废水,加入可溶性钡盐后,废水中Ba2+的浓度应大于__mol·L-1,废水处理后达到国家标准才能排放。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A.乙醇和丙三醇互为同系物
B.环己烯(![]() )分子中的所有碳原子共面
)分子中的所有碳原子共面
C.分子式为C5H10O2,且属于酯的同分异构体共有9种(不考虑立体异构)
D.二环己烷( ![]() )的二氯代物有6种结构(不考虑立体异构)
)的二氯代物有6种结构(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2硝基1,3苯二酚由间苯二酚先磺化,再硝化,后去磺酸基生成。原理如下:

部分物质的相关性质如下:
名称 | 相对分子质量 | 性状 | 熔点/℃ | 水溶性(常温) |
间苯二酚 | 110 | 白色针状晶体 | 110.7 | 易溶 |
2硝基1,3苯二酚 | 155 | 桔红色针状晶体 | 87.8 | 难溶 |
制备过程如下:
第一步:磺化。称取71.5g间苯二酚,碾成粉末放入烧瓶中,慢慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内15min(如图1)。
第二步:硝化。待磺化反应结束后将烧瓶置于冷水中,充分冷却后加入“混酸”,控制温度继续搅拌15min。
第三步:蒸馏。将硝化反应混合物的稀释液转移到圆底烧瓶B中,然后用图2所示装置进行水蒸气蒸馏(水蒸气蒸馏可使待提纯的有机物在低于100℃的情况下随水蒸气一起被蒸馏出来,从而达到分离提纯的目的)。

请回答下列问题:
(1)磺化步骤中控制温度最合适的范围为(填字母)__。
a.30℃~60℃ b.60℃~65℃ c.65℃~70℃ d.70℃~100℃
(2)图2中的冷凝管是否可以换为图1所用冷凝管___(填“是”或“否”)。
(3)硝化步骤中制取“混酸”的具体操作是__。
(4)图2中,烧瓶A中长玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能防止__;冷凝管C中可能看到的现象是__,反应一段时间后,停止蒸馏,此时的操作是__(填有关旋塞和酒精灯的操作)。
(5)水蒸气蒸馏是分离和提纯有机物的方法之一,被提纯物质必须具备的条件正确的是__。
a.不溶或难溶于水,便于最后分离
b.在沸腾下与水不发生化学反应
c.难挥发性
d.易溶于水
(6)本实验最终获得12.0g桔红色晶体,则2硝基1,3苯二酚的产率约为__。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,用0. 1mol/L 盐酸滴定20mL 0. 1mol/L 氨水的图像如图所示,下列说法正确的是
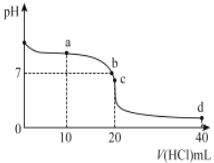
A.a点时2c(Cl-)=c(NH3H2O)+c (NH4+)
B.b点表示酸碱恰好完全反应
C.c点时c(NH4+)>c(Cl-)>c(H+ )>c(OH- )
D.a 、b、c、d均有c(NH4+)+c(H+) = c(Cl-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是大气主要污染物,主要来自于工业废气及汽车尾气的排放,工业废气中NO是主要成分之一。
(1)乙烯作为还原剂的脱硝(NO),其反应机理示意图如图所示.写出解吸过程的化学方程式____________________。

(2)FeSO4-Na2SO3复合吸收剂吸收烟气中的NO,该方法利用Fe2+易与NO发生络合反应的特性,原理如下NO+FeSO4![]() Fe(NO)SO4
Fe(NO)SO4
①如图是一段时间内不同吸收剂对NO脱除率对比,加入Na2SO3溶液后,吸收效率增强,除了Na2SO3也能吸收部分NO外,还能防氧化从而增大Fe2+的含量,写出此原理的离子方程式_______________________________________。

②模拟实验表明,温度过高或过低都会降低NO的脱除率,其原因是_______________________________________。
(3)采用无隔膜法电解食盐水脱氮可将氮氧化物转化成NO3-,原理如图

①无隔膜条件下电解食盐水后溶液呈弱碱性,原因是____________________________.
②写出NO发生反应的离子方程式____________________________。
③根据下图所示,脱NO过程中控制溶液pH在______________范围内更合理。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是( )
A.1mol碳正离子(CH3+)所含的电子总数为9NA
B.25℃,pH=13的Ba(OH)2 溶液中含有OH-的数目为0.1NA
C.常温常压下,过氧化钠与水反应时,生成8g氧气转移的电子数为0.5NA
D.1mol雄黄(As4S4),结构如图:![]() ,含有2NA个S-S键
,含有2NA个S-S键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用一种钴矿石(主要成分为 Co2O3,含少量 SiO2及铁、铝、锰、镁、钙等金属元素的氧化物)制取CoC2O42H2O 晶体的工艺流程如下:
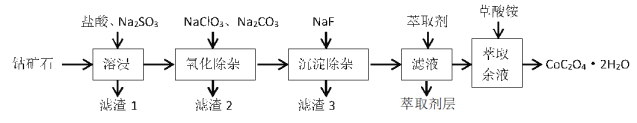
已知部分阳离子以氢氧化物形式沉淀时溶液 pH 如表
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的 pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)溶浸过程中 Co2O3 发生反应的离子方程式为_____。
(2)氧化除杂过程中加入 Na2CO3 的主要目的是__________,若不加入 NaClO3,其后果是_____。
(3)滤渣 3 的成分是____________,滤液中加入萃取剂的目的是除去_________元素(填元素符号)。
(4)萃取余液中加入草酸铵后,获取 CoC2O4·2H2O 晶体的操作是___________。
(5)含钴化合物 LiCoO2是废旧锂电池的正极材料,可与双氧水、稀 H2SO4 混合加热得到 CoSO4回收利用,该过程发生反应的化学方程式是____________。
(6)已知某温度下 Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10,当加入过量NaF溶液后,所得滤液中c(Ca2+)/c(Mg2+) =___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组为了分析补血剂 FeSO4·7H2O 中铁元素的质量分数,用 KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4- +8H+= 5Fe3++Mn2++4H2O。
(1)实验前,首先要精确配制一定物质的量浓度的 KMnO4 溶液 250 mL,配制时需要用的仪器除天平、药匙、玻璃棒、烧杯、胶头滴管外,还需____________。
(2)滴定前是否要滴加指示剂?_____(填“是”或“否”),理由是_____。
(3)某同学设计的下列滴定方式中,最合理的是_____(填序号)
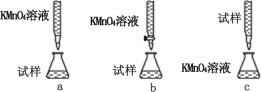
(4)该实验小组称取 12.0 g 补血剂在容量瓶中配成 100 mL 溶液,量取 25.00 mL 试样溶液, 用 0.100 mol·L-1 KMnO4标准溶液滴定。 达到滴定终点时, 消耗标准溶液20.00 mL,则所测补血剂中铁元素的质量分数是_____(精确至 0.01%)。
(5)若该小组配制溶液和滴定操作时引起的误差忽略,最终所测补血剂中铁元素含量 仍偏小,其可能原因是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com