
| A. | 用K37ClO3与浓盐酸制氯气:37ClO3-+6H++6Cl-═37Cl-+3Cl2↑+3H2O | |
| B. | 在溶液中等物质的量的FeBr2与Cl2反应:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 将1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积均匀混合 AlO2-+H++H2O═Al(OH)3↓ | |
| D. | 0.1mol/L的Na2CO3溶液中2 C(Na+)═C (HCO3-)+C (H2CO3)+C(CO32-) |
分析 A.37ClO3-+6H++6Cl-═37Cl-+3Cl2↑+3H2O,K37ClO3中Cl元素的化合价由+5价降低为0,反应物的Cl-中Cl元素的化合价由-1价升高为0;
B.溴离子的还原性小于亚铁离子,氯气不足时亚铁离子优先反应,剩余的氯气再与溴离子反应;
C.二者的物质的量比为2:5,1molAl(OH)3消耗3molH+,反应生成等量的铝离子、氢氧化铝;
D.根据碳酸钠溶液中的物料守恒判断.
解答 解:A.氧化还原反应37ClO3-+6H++6Cl-═37Cl-+3Cl2↑+3H2O中,K37ClO3中Cl元素的化合价由+5价降低为0,反应物的Cl-中Cl元素的化合价由-1价升高为0,即:反应产物中的氯离子来自盐酸,故A错误;
B.亚铁离子的还原性大于溴离子,则氯气优先氧化亚铁离子,剩余的氯气再与溴离子反应,当FeBr2与Cl2的物质的量相等时,反应的离子方程式为:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-,故B正确;
C.1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积混合,偏铝酸根离子与氢离子的物质的量比为2:5,反应生成铝离子和氢氧化铝沉淀,正确的离子方程式为:2AlO2-+5H+=Al3++Al(OH)3↓+H2O,故C错误;
D.Na2CO3溶液中存在物料守恒:c(Na+)═2c(HCO3-)+2c(H2CO3)+2c(CO32-),故D错误;
故选B.
点评 本题考查了离子方程式书写判断、离子浓度大小比较,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子浓度大小比较的常用方法.


科目:高中化学 来源: 题型:解答题
 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)2C=CHCH2CH3的名称为2-甲基-2-戊烯 | |
| B. | 乙醇、乙二醇、丙三醇的沸点依次升高 | |
| C. | 1mol乙酰水杨酸(  )最多可以和2mol NaOH反应 )最多可以和2mol NaOH反应 | |
| D. | 可用 和HCHO 为原料合成 和HCHO 为原料合成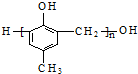 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下向10mlPH=12的NaOH溶液中加入PH=2的HA至PH=7所得的溶液的总体积V≧20ml | |
| B. | 在做中和滴定实验时向滴有酚酞的NaOH溶液中滴加盐酸至溶液恰好无色,此时溶液PH<7 | |
| C. | 肥田粉溶于水所得溶液中C(NH4+)>C(SO42-)>C(H+)>C(OH-) | |
| D. | PH>7的草酸钾溶液中C(OH-)-C(H+)=4 C(H2C2O4)+2 C(HC2O4-)+2 C(C2O42-)-C(K+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水稀释,溶液中所有离子的浓度都减小 | |
| B. | 溶液中n(CH3COO-)+n(CH3COOH)=0.1mol | |
| C. | 升高温度,醋酸的电离度增大 | |
| D. | 中和1L等物质的量浓度的NaOH溶液所消耗的醋酸体积大于1L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com