
制取NH4NO3的流程如图所示:
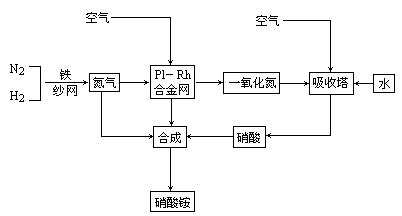
试回答下列问题:
(1)合成氨的原料通常各来自何处?(2)为有效提高氨的产率,实际生产中宜采取哪些措施?(3)铂-铑合金有何作用?为什么铂铑合金未预热也会发热?(4)生产硝酸的过程中常会产生一些氮的氧化物,如何消除它们对大气的污染?写出反应式.(5)举出硝酸铵的两种主要用途.解释为什么该用途对现代社会非常重要?
科目:高中化学 来源: 题型:
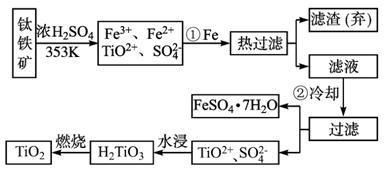
图2-3-3
(1)Ti的原子序数为22,Ti位于元素周期表中第_________周期,第_________族。
(2)步骤①加Fe的目的是:_____________________________________________;
步骤②冷却的目的是:________________________________________________。
(3)上述制备TiO2的过程中,可以利用的副产物是_________;考虑成本和废物综合利用因素,废液中应加入_________处理。
(4)由金红石(TiO2)制取单质Ti,涉及的步骤为:
![]()
已知:①C(s)+O2(g)====CO2(g); ΔH=-393.5 kJ·mol-1
②2CO(g)+O2(g)====2CO2(g); ΔH=-566 kJ·mol-1
③TiO2(s)+2Cl2(g)====TiCl4(s)+O2(g); ΔH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)====TiCl4(s)+2CO(g)的ΔH=_________。
反应TiCl4+2Mg====2MgCl2+Ti在Ar气氛中进行的理由是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上从铝土矿(含氧化铝、氧化铁等)制取铝的流程如图所示 :

经分析,生产原料(铝土矿)和提取Al2O3后的残渣(赤泥)的部分成分见下表(以氧化物表示)且已知铝土矿中的Fe2O3全部转入赤泥。
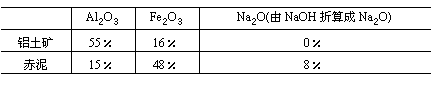
(1)生产中每消耗1t铝土矿将产生多少吨赤泥?
(2)试计算出每炼1t铝,理论上需要多少吨铝土矿?
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)工业上从铝土矿(含氧化铝、氧化铁等)制取铝的流程如图所示 :
经分析,生产原料(铝土矿)和提取Al2O3后的残渣(赤泥)的部分成分见下表(以氧化物表示)且已知铝土矿中的Fe2O3全部转入赤泥。
(1)生产中每消耗1t铝土矿将产生多少吨赤泥?
(2)试计算出每炼1t铝,理论上需要多少吨铝土矿?
查看答案和解析>>
科目:高中化学 来源:江苏省2010-2011学年高三化学一轮过关测试(2) 题型:填空题
(12分)工业上从铝土矿(含氧化铝、氧化铁等)制取铝的流程如图所示 :

经分析,生产原料(铝土矿)和提取Al2O3后的残渣(赤泥)的部分成分见下表(以氧化物表示)且已知铝土矿中的Fe2O3全部转入赤泥。

(1)生产中每消耗1t铝土矿将产生多少吨赤泥?
(2)试计算出每炼1t铝,理论上需要多少吨铝土矿?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com