
| A. | 二甲醚与乙醇是同分异构体 | |
| B. | 该燃料电池中通入二甲醚的一极为正极 | |
| C. | 二甲醚作为汽车燃料不会产生氮的氧化物和碳氢化合物的污染 | |
| D. | 在燃料电池中二甲醚最终转化为CO2和H2O |
分析 该电池属于燃料电池,负极上燃料二甲醚失电子发生氧化反应,电极反应式为CH3OCH3+160H--12e-═2CO32-+11H2O,正极上氧气得电子发生还原反应,电极反应式为3O2+12e-+6H2O=12OH-,结合物质间的关系式解答.
解答 解:A.乙醇和二甲醚具有相同的分子式、不同结构,二者互为同分异构体,故A正确;
B.该燃料电池中,二甲醚失电子发生氧化反应,所以通入二甲醚的电极是负极,电极反应式为CH3OCH3+160H--12e-═2CO32-+11H2O,故B错误;
C.二甲醚属于有机物,燃烧生成二氧化碳和水,所以不产生氮的氧化物和碳氢化合物的污染,故C正确;
D.碱性电池中,二氧化碳能和氢氧根离子反应生成碳酸根离子,所以二甲醚最终转化为碳酸根离子和水,故D错误.
故选AC.
点评 本题考查了原电池原理,明确正负极上发生的电极反应式是解本题关键,注意电极反应式的书写要结合电解质溶液的酸碱性,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 | B. | 8 | C. | 9 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水加热到很高的温度都难以分解 | |
| B. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| C. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 | |
| D. | 水结成冰体积膨胀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径按X、Y、Z、R、W的顺序一次增大 | |
| B. | WY2能与强碱溶液反应,但不能与任何酸反应 | |
| C. | Z与Y形成的化合物是碱性氧化物 | |
| D. | W的最高价氧化物对应的水化物难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
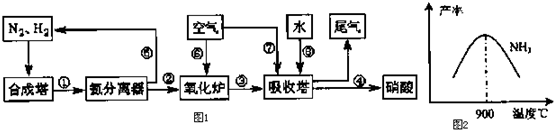
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
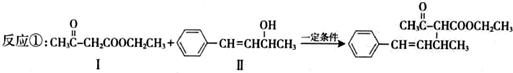
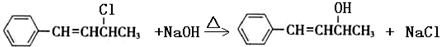 .
.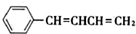 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、汽油、植物油和聚乙烯塑料都是碳氢化合物 | |
| B. | 葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体 | |
| C. | 水电站把机械能转化成电能,而核电站是把化学能转化成电能 | |
| D. | 糖类、油脂、蛋白质都是高分子化合物,都能发生水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com