
| A、X、M两种元素形成的化合物的中一定含有离子键,不可能含有共价键 |
| B、由于W、Z、M元素的氢化物的相对分子质量依次减小,所以其沸点依次降低 |
| C、元素Y、Z、W、M的电负性高低顺序为:M>W>Z>Y |
| D、化合物ZW2的分子空间构型为直线形 |


 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
| A、含1 mol溶质的任何溶液,物质的量浓度一定相等 |
| B、配制1 mol/L NaCl溶液1 L,其方法是:将58.5 g NaCl溶于1 L水中即可 |
| C、体积相同、物质的量浓度相同的同种溶液所含溶质的粒子数一定相同 |
| D、1 L 0.5 mol/L CaCl2溶液中,Ca2+与Cl-的物质的量浓度都是0.5 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和滴定实验时,用待测液润洗锥形瓶 |
| B、盛放NaOH溶液时,使用带玻璃瓶塞的磨口瓶 |
| C、在用PH试纸测溶液的pH值时,用镊子夹取试纸伸到试剂瓶中取液,将颜色与标准比色卡对照,读出数值 |
| D、向纯碱溶液加入酚酞,溶液显红色,将该溶液加热,则红色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
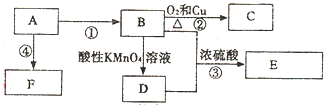
查看答案和解析>>
科目:高中化学 来源: 题型:
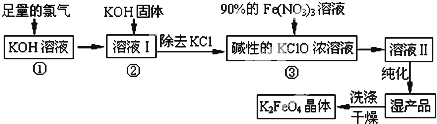
查看答案和解析>>
科目:高中化学 来源: 题型:
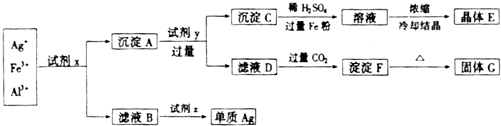
查看答案和解析>>
科目:高中化学 来源: 题型:
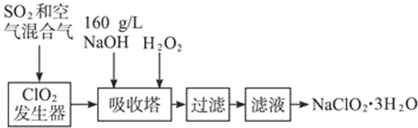
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com