
| A. | 马口铁(镀锡铁)镀层破损铁的腐蚀速率加快 | |
| B. | 为了防止钢铁设备腐蚀,利用外加电流的阴极保护法,应另附加一惰性电极,惰性电极作阴极 | |
| C. | 可以采用改变金属组成或结构的方法防止金属腐蚀 | |
| D. | 为保护海轮的船壳,利用牺牲阳极的阴极保护法,常在船壳上镶入锌块 |
分析 A、马口铁(镀锡)的表面一旦破损,构成原电池,Fe为负极;
B、电解池中,阳极被腐蚀,阴极被保护;
C、将金属制成合金,即改变金属的组成和结构;
D、原电池的正极金属易被保护,不易腐蚀.
解答 解:A、马口铁(镀锡)的表面一旦破损,构成原电池,Fe为负极,则铁腐蚀加快,故A正确;
B、电解池中,阳极被腐蚀,阴极被保护,故应将钢铁的设备做阴极,故B错误;
C、将金属制成合金,即改变金属的组成和结构,能起到很好的防止腐蚀的作用,故C正确;
D、海轮外壳镶嵌锌块,此时铁作为原电池的正极金属而被保护,不易腐蚀,是采用了牺牲阳极的阴极保护法,故D正确.
故选B.
点评 本题考查原电池的工作原理,明确金属活泼性及原电池的负极易被腐蚀为解答的关键,注意电极判断的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 摩尔质量g/mol | B. | 气体摩尔体积L/mol | ||
| C. | 溶解度g/100g | D. | 物质的量浓度mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | B. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | ||
| C. | CaO+H2O═Ca(OH)2 | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
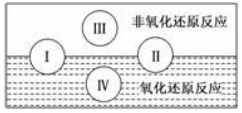
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molC2H6中含有6 NA个共价键 | |
| B. | 7.8 g Na2O2中含有的阳离子数和阴离子数均为0.2NA | |
| C. | 14.0g由C2H4和C3H6组成的混合气体原子总数为3NA | |
| D. | 5.6g金属铁与足量盐酸反应时失去的电子数是0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| B. | 常温常压下,5.6g乙烯(C2H4)与丁烯(C4H8)的混合物中含有的氢原子的数目为0.8NA | |
| C. | 在50 g质量分数为46%的乙醇水溶液中,含有的氢原子总数为3NA | |
| D. | 1mol Fe与足量的稀硫酸反应转化为Fe3+失去的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
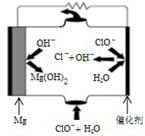 利用所学知识回答下列问题
利用所学知识回答下列问题| K1 | K2 | |
| H2SO3 | 1.3×10-2 | 1.0×10-7 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Hg(l)+H2SO4(aq)═HgSO4(aq)+H2(g)常温下不能自发进行,说明△H<0 | |
| B. | 用惰性电极电解1L1mol/L的CuSO4溶液,当阴极析出3.2 g铜时,加入0.05 molCu(OH)2固体可将溶液恢复至原浓度 | |
| C. | 已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl溶解度大于Ag2CrO4溶解度 | |
| D. | 25℃时,向0.1 mol/L CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com