
����˵����ȷ����( )
A.ij�л���ȼ��ֻ����CO2��H2O���Ҷ������ʵ�����ȣ�����л����
N(C):N(H)=1:2
B.һ��������������������ȫȼ�պ�IJ���ͨ����ʯ�ң����ٵ�����������ɵ�
������̼�����(�¶�>100��)
C.ij��̬��CxHy������O2��ȫ��Ӧ�������Ӧǰ������������䣨�¶�<100�棩��
��y��4����������٣���y��4������y��4
D.��ͬ������������ȫȼ�գ�����O2Խ�࣬��������C��Hԭ�Ӹ�����Խ��
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���й���卑���������ȷ���ǣ� ��
A������������ӻ�����
B�����ơ��ء�����ֵ����У�卑��۵����
C���������������
D����λ�����ڱ��ĵ������ڡ��ڢ�A��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������(NaNO2)��һ�ֹ�ҵ�Σ�ʵ���ҿ�������װ��(��ȥ���ּг�����)�Ʊ���
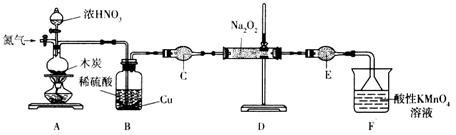
��֪����2NO+Na2O2=2NaNO2��
��3 NaNO2+3HCl=3NaCl+HNO3+2NO��+H2O��
�����������£�NO��NO2������MnO4-��Ӧ����NO3-��Mn2+��Na2O2��ʹ���Ը��������Һ��ɫ��
(1)����װ��Aǰ����ͨһ��ʱ��N2��Ŀ����_______________��
(2)װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ__________________________________��ʵ�������Bƿ�е���Һ������Ũ����__________(���������)�����˿ɻ��CuSO4��5H2O��
(3)����C������Ϊ______________������ʢ�ŵ�ҩƷΪ ____________(������)��
(4)��ַ�Ӧ����װ��D�в���ķ����ǣ�ȡ�������������Թ��У�___________________________���������NaNO2(ע���Լ�������)��
(5)Ϊ�ⶨ�������Ƶĺ�������ȡ4.000g��Ʒ����ˮ���250mL��Һ��ȡ25��00mL��Һ����ƿ�У���0.1000mol��L-1����KMnO4��Һ���еζ���ʵ�������������±���ʾ��
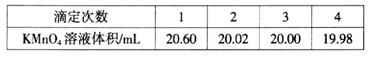
�ٵ�һ��ʵ�����ݳ����쳣����������쳣��ԭ�������_________(�����)��
a����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ
b����ƿϴ����δ����
c���ζ��յ�ʱ���Ӷ���
�ڸ��ݱ������ݣ��������ù������������Ƶ���������__________��
(6)��ƺ���ʵ��Ƚ�0��1 mol��L-1NaNO2��Һ��NO2-��ˮ��̶Ⱥ�0.1 mol��L-1HNO2��Һ��HNO2�ĵ���̶���Դ�С��(��Ҫ˵��ʵ�鲽�衢����ͽ��ۣ�������ҩƷ��ѡ)
___________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ó��ӵ��Լ��Ͳ�����������ȷ����(�� )
| ѡ�� | ���� | ���� | �����Լ� | �������� |
| �� | ��ϩ | �������� | KMnO4��Һ | ϴ�� |
| �� | ��Ȳ | ���� | ����������Һ | ϴ�� |
| �� | �� | �ױ� | ��ˮ | ��Һ |
| �� | �屽 | Һ�� | ����������Һ | ��Һ |
A �ڢ� B.�٢� C.�ڢ� D.�٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����ȷ����(NA��ʾ�����ӵ�������ֵ) (����)
A.1 mol����ϩ���е�ԭ����ĿΪ6NA
B.��״���£�11.2L CHCl3�������е�ԭ������Ϊ2.5NA
C.һ�������£�2.6 g��Ȳ��������̬�����������̼ԭ����Ϊ0.2NA
D.1 mol����1mol�ǻ�������������Ϊ10 NA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵��������������Ȼ��г�ദ����
A���õ綯��������ȼ������
B��������ϩ������������������뺣��
C����������̫���ܡ����ܵ���Դ�����ʯȼ��
D������ʵʩ����ȼ�ϵ��������������Լ���SO2��NOx���ŷ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�Ӵ��������Ṥ���У�������Ӧ��450�沢�д��������½��У�
2SO2(g) + O2(g) 
 2SO3(g)
2SO3(g)  H=��197 kJ/mol������˵����ȷ����
H=��197 kJ/mol������˵����ȷ����
A��ʹ�ô����������SO2��ת����
B������O2��Ũ�ȿ�����߷�Ӧ���ʺ�SO2��ת����
C����Ӧ450��ʱ��ƽ�ⳣ��С��500��ʱ��ƽ�ⳣ��
D������ƽ������ϵѹǿ�� v������v���С��ƽ��������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���й������ӵ�������ȷ���ǣ�������
| �� | A�� | ��c��H+��=1��10﹣13mol•L﹣1����Һ�У�Na+��Fe3+��Cl﹣��SO42﹣�ܴ������� |
| �� | B�� | ͭ����FeCl3��Һ�У�Cu+Fe3+=Fe2++Cu2+ |
| �� | C�� | NaHCO3��Һ�У�c��Na+��=c��CO32﹣��+c��HCO3﹣��+c��H2CO3�� |
| �� | D�� | ����Һ�м���BaCl2��Һ���ټ����ᣬ�а�ɫ������˵������Һ��һ������SO42﹣ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����йػ�ѧ�����ʾ��ȷ����(����)
A��H3O���ĵ���ʽ��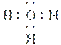
B������Ķ��ȴ���������(�����������칹)
C��������Ľṹʽ��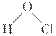
D��HS����ˮ�⣺HS����H2OH2S��OH��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com