
| A. | 大理石溶于醋酸的反应:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| B. | 实验室制取CO2:CO32-+2H+═CO2↑+H2O | |
| C. | 铁和硝酸银溶液反应:Fe+Ag+═Ag+Fe2+ | |
| D. | Ca(HCO3)2溶液中加入过量KOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
分析 A.反应生成醋酸钙、水、二氧化碳;
B.利用碳酸钙与盐酸反应制备;
C.电子、电荷不守恒;
D.反应生成碳酸钙、碳酸钾、水.
解答 解:A.大理石溶于醋酸的反应的离子反应为CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O,故A正确;
B.实验室制取CO2的离子反应为CaCO3+2H+═Ca2++CO2↑+H2O,故B错误;
C.铁和硝酸银溶液反应的离子反应为Fe+2Ag+═2Ag+Fe2+,故C错误;
D.Ca(HCO3)2溶液中加入过量KOH溶液的离子反应为Ca2++2HCO3-+2OH-═CO32-+CaCO3↓+2H2O,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及离子反应中电子、电荷守恒,题目难度不大.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:推断题
 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下不同情况回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下不同情况回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①或② | B. | 只有②或④ | ||
| C. | 只有①或②或③ | D. | 上述四种物质中任意一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 ,由上述实验可知,该溶液中可以肯定存在的离子有SO32-、S2-、CO32-.
,由上述实验可知,该溶液中可以肯定存在的离子有SO32-、S2-、CO32-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 有关信息 |
| X | 最外层电子数是次外层的2倍 |
| Y | 元素主要化合价为-2价 |
| Z | 其单质及化合物的焰色为黄色 |
| M | 与X同主族,其单质为半导体材料 |
| N | 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
 ;Z2Y2中所含化学键类型是离子键和非极性共价键;XY2与Z2Y2反应的化学方程式是2CO2+2Na2O2=2Na2CO3+O2.
;Z2Y2中所含化学键类型是离子键和非极性共价键;XY2与Z2Y2反应的化学方程式是2CO2+2Na2O2=2Na2CO3+O2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BrCH2CH2CH2CH2CH2Br | B. | 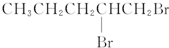 | ||
| C. | 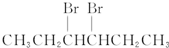 | D. | CH3CH2CH2CH2CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
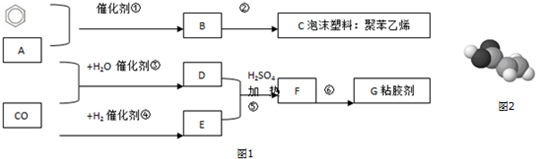

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com