
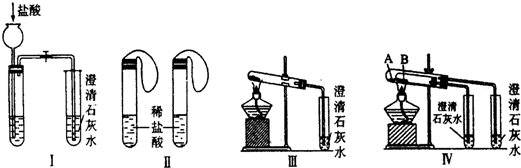
分析 (1)试管A中温度高、试管B中温度低,将碳酸氢钠放在试管低的试管中,如果碳酸氢钠分解了而碳酸钠没有分解,据此可以证明碳酸钠的稳定性大于碳酸氢钠;试管A连接的是右边的小试管,试管B连接的是左边的小试管,澄清石灰水变浑浊,证明对应的物质稳定性小;
(2)根据实验现象是否有明显区别进行判断;
(3)取a克混合物充分加热,最后减重b克,发生2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,结合方程式计算.
解答 解:(1)给碳酸钠直接加热,碳酸氢钠不直接加热,不直接加热的碳酸氢钠能分解而直接加热的碳酸钠不分解更能说明碳酸氢钠不稳定;当右边试管中的石灰水不变浑浊,而左边试管中的石灰水变浑浊,说明碳酸钠比碳酸氢钠稳定,
故答案为:NaHCO3;右边试管中的石灰水不变浑浊,而左边试管中的石灰水变浑浊;
(2)无论碳酸钠还是碳酸氢钠都能和盐酸反应生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊,故Ⅰ无法鉴别;而Ⅱ利用等质量的碳酸钠、碳酸氢钠产生的二氧化碳的体积不同可以鉴别,Ⅲ可以通过分别加热碳酸钠、碳酸钠,根据澄清石灰水是否变浑浊鉴别、Ⅳ根据澄清石灰水是否变浑浊鉴别二者,所以能够达到实验目的是Ⅱ、Ⅲ、Ⅳ;
故答案为:Ⅱ、Ⅲ、Ⅳ;
(3)加热过程中碳酸钠不变,碳酸氢钠分解,反应的方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,反应前后固体质量变化为:bg,
则2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ 减少的固体质量△m
168 106 62
m(NaHCO3) bg
m(NaHCO3)=$\frac{168b}{62}$g=$\frac{84b}{31}$g,
则碳酸钠的质量分数为$\frac{a-\frac{84b}{31}}{a}×100%$,
故答案为:$\frac{a-\frac{84b}{31}}{a}×100%$.
点评 该题考查碳酸钠与碳酸氢钠的性质比较,是高考中的常见题型,属于中等难度试题的考查.该题基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和应试能力.


 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 加入试剂 | 离子方程式 |
| NH4Cl(AlCl3)溶液 | ||
| NaHCO3(Na2CO3)溶液 | ||
| Fe 粉(Al粉) | ||
| FeCl3(FeCl2)溶液 |
 15.(18分)
15.(18分) ,反应类型是加聚反应.
,反应类型是加聚反应.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡.试回答
如图装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡.试回答查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 | |
| B. | 用装置①进行电镀,镀件接在b极上 | |
| C. | 装置②的总反应是:Cu+Fe3+═Cu2++Fe | |
| D. | 装置③中的铁钉几乎没被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用容量瓶前检查它是否漏水 | |
| B. | 容量瓶用蒸馏水洗净后,再用待配溶液润洗 | |
| C. | 盖好瓶塞,用食指顶住瓶塞,用另一只手指托住瓶底,把容量瓶倒转和摇动几次 | |
| D. | 容量瓶不能长期存放配制好的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com