
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25 ℃、101 kPa时,8 g CH4完全燃烧生成液态水时放出的热量是445.15 kJ,则CH4燃烧的热化学方程式是 。
(2)已知:C(s) + O2(g)  CO2(g) ΔH=-437.3 kJ?mol-1
CO2(g) ΔH=-437.3 kJ?mol-1
H2(g) + 1/2 O2(g)  H2O(g) ΔH=-285.8 kJ?mol-1
H2O(g) ΔH=-285.8 kJ?mol-1
CO(g) + 1/2 O2(g)  CO2(g) ΔH=-283.0 kJ?mol-1
CO2(g) ΔH=-283.0 kJ?mol-1
则煤的气化主要反应的热化学方程式是:C(s) + H2O(g)  CO(g) + H2(g) ΔH= kJ?mol-1。如果该反应ΔS=+133.7 J·K-1·mol-1 该反应在常温(25 ℃)下能否自发进行?(△G=△H-T△S) (填“能”或“不能”,并写出判断依据).
CO(g) + H2(g) ΔH= kJ?mol-1。如果该反应ΔS=+133.7 J·K-1·mol-1 该反应在常温(25 ℃)下能否自发进行?(△G=△H-T△S) (填“能”或“不能”,并写出判断依据).
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ·mol-1 | 436 | 391 | 945 |
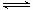 2NH3 △H="a" kJ·mol-1。试根据表中所列键能数据估算a的数值为 。
2NH3 △H="a" kJ·mol-1。试根据表中所列键能数据估算a的数值为 。 (3)-93
解析试题分析:(1)在25 ℃、101 kPa时,8 g CH4完全燃烧生成液态水时放出的热量是445.15 kJ,则1molCH4在氧气中燃烧生成CO2和液态水,放出889kJ热量,热化学方程式为:
CH4(g)+2O2(g)═CO2(g)+2H2O△H=-890.31KJ/mol;
(2)已知①C(s) + O2(g)  CO2(g) ΔH=-437.3 kJ?mol-1
CO2(g) ΔH=-437.3 kJ?mol-1
②H2(g) + 1/2 O2(g)  H2O(g) ΔH=-285.8 kJ?mol-1
H2O(g) ΔH=-285.8 kJ?mol-1
③CO(g) + 1/2 O2(g)  CO2(g) ΔH=-283.0 kJ?mol-1
CO2(g) ΔH=-283.0 kJ?mol-1
依据盖斯定律①-②-③,得到:C(s)+H2O(g)═CO(g)+H2(g) △H=+131.5kJ?mol-1,△G=△H-T?△S=131.5kJ?mol-1-0.1337KJ?K-1?mol-1×298K=91.65kJ?mol-1>0,不能自发进行;(3)化学反应的焓变等于反应物的键能之和减生成物的键能之和,△H=(945+3×436—6×391)kJ?mol-1="-93" kJ?mol-1,a=—93。
考点:考查热化学方程式的书写、反应方向的判断、焓变的计算。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:单选题
今有如下三个热化学方程式:
H2(g)+ 1/2 O2(g) = H2O(g) ; △H=a kJ/mol
H2(g)+ 1/2 O2(g) =H2O(l) ; △H=b kJ/mol
2 H2(g)+ O2(g) ="2" H2O(l) ; △H=c kJ/mol
下列关于它们的表述正确的是( )
| A.它们都是吸热反应 | B.a、b和c均为正值 |
| C.反应热的关系:a=b | D.反应热的关系:2b=c |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答 下列问题: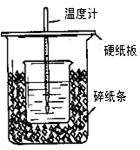
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、
无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”);所求中和热_______ (填“相等、不相等”)。
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)能源是影响经济和生活的重要因素。目前人类已开发和利用的能源中,氢气是一种最理想的清洁能源。试填写下列空格。
(1)点燃氢气时,化学能主要转化为 ;
(2)氢气在原电池中反应时,化学能主要转化为 ;
(3)若在常温常压下,上述两种方式都反应1molH2,则放出的能量 (填“相同”或“不相同”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)已知:H2(g)+O2(g) H2O(g),反应过程中能量变化如图所示,则:
H2O(g),反应过程中能量变化如图所示,则: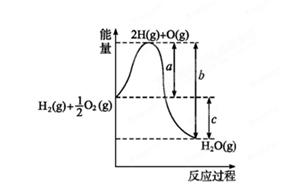
①试写出a、b、c分别代表的意义:
a ;
b ;
c 。
②该反应是 反应(填“吸热”或“放热”),ΔH 0(填“>”或“<”)。
(2)发射“天宫”一号的火箭使用的推进剂是液氢和液氧,这种推进剂的优点是 , 。(请写两条)
(3)已知:H2(g)+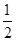 O2(g)=H2O(l) ΔH="-285.8" kJ·mol-1
O2(g)=H2O(l) ΔH="-285.8" kJ·mol-1
H2(g)==H2(l) ΔH="-0.92" kJ·mol-1
O2(g)==O2(l) ΔH="-6.84" kJ·mol-1
H2O(l)=H2O(g) ΔH="+44.0" kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分) 1909年化学家哈伯在实验室首次合成了氨。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体表面合成氨的反应过程,示意如下图: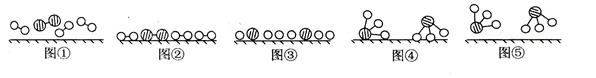
(1)图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是______,______。
(2)已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g); ΔH= - 1266.8 kJ/mol
N2(g) + O2(g) =" 2NO(g)" ; ΔH =" +" 180.5kJ/mol, 氨催化氧化的热化学方程式为__________。
(3)500℃下,在A、B两个容器中均发生合成氨的反应。隔板Ⅰ固定不动,活塞Ⅱ可自由移动。
①当合成氨在容器B中达平衡时,测得其中含有1.0molN2,0.4molH2,0.4molNH3,此时容积为2.0L。则此条件下的平衡常数为____________;保持温度和压强不变,向此容器中通入0.36molN2,平衡将__________(填“正向”、“逆向”或“不”)移动。
②向A、B两容器中均通入xmolN2和ymolH2,初始A、B容积相同,并保持温度不变。若要平衡时保持N2在A、B两容器中的体积分数相同,则x与y之间必须满足的关系式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知在250C、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题(H2O相对分子质量为18):
(1)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 _ __570 kJ(填“>”、“<”或“=”)。
(2)现有250C、1.013×105Pa下的H2和CH4的混合气体0.5mol,完全燃烧生成一定质量的CO2气体和10.8gH2O(l),放出203kJ的热量,则1molCH4 完全燃烧生成CO2气体和H2O(l)的热化学方程式为 。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:A、B两个电极均由多孔的碳块组成。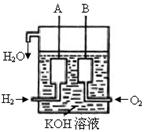
该电池的正极为:______(填A或B)。电极反应式为 ________ ____ 。
(4)若将上述装置中通入H2的改成CH4气体,也可以组成一个原电池装置,电池的总反应为:CH4+2O2+2KOH = K2CO3+3H2O ,则该电池的负极反应式为:______ _ _ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(共14分)甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) H2O (g)+CO(g) H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
③3H2(g)+ CO2(g) CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) | K3 | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=akJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=akJ·mol-1,平衡常数为K;
反应②CO(g)+1/2O2(g) CO2(g) ΔH=bkJ·mol-1;
CO2(g) ΔH=bkJ·mol-1;
反应③Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH=ckJ·mol-1。测得在不同温度下,K值如下:
2Fe(s)+3CO2(g) ΔH=ckJ·mol-1。测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
 2FeO(s)的ΔH= 。
2FeO(s)的ΔH= 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com