
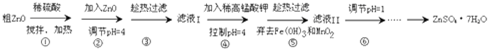
分析 由工艺流程可知,步骤①粗ZnO与硫酸反应,通过搅拌可以加快反应速率,结合步骤④加入高锰酸钾,调节pH=4,有氢氧化铁、二氧化锰生成,根据控制的PH值及原子守恒、电荷守恒可知,都有水参加反应,同时还生成氢离子,④发生反应:MnO4-+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+、2MnO4-+3Mn2++2H2O=5MnO2↓+4H+,故步骤②加入ZnO,调节溶液pH=4,是使溶液中一些离子转化为沉淀,由于锌离子水解,步骤⑥中调pH=1目的是抑制Zn2+的水解,再经过蒸发浓缩、降温结晶、过滤得到ZnSO4•7H2O.
解答 解:由工艺流程可知,步骤①粗ZnO与硫酸反应,通过搅拌可以加快反应速率,结合步骤④加入高锰酸钾,调节pH=4,有氢氧化铁、二氧化锰生成,根据控制的PH值及原子守恒、电荷守恒可知,都有水参加反应,同时还生成氢离子,④发生反应:MnO4-+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+、2MnO4-+3Mn2++2H2O=5MnO2↓+4H+,故步骤②加入ZnO,调节溶液pH=4,是使溶液中一些离子转化为沉淀,由于锌离子水解,步骤⑥中调pH=1目的是抑制Zn2+的水解,再经过蒸发浓缩、降温结晶、过滤得到ZnSO4•7H2O.
(1)步骤①中酸浸过程中搅拌,使反应物充分接触,可以加快反应速率,
故答案为:加快反应速率;
(2)步骤③、⑤中趁热过滤所需硅酸盐仪器有:漏斗、烧杯、玻璃棒,证明滤液Ⅱ中没有Fe3+ 的实验方案为:取少量样品于试管中,滴加适量KSCN溶液,观察若溶液出现血红色,则证明含有Fe3+,反之则没有Fe3+,
故答案为:漏斗、烧杯、玻璃棒;取少量样品于试管中,滴加适量KSCN溶液,观察若溶液出现血红色,则证明含有Fe3+,反之则没有Fe3+;
(3)由工艺流程可知,加入高锰酸钾有氢氧化铁、二氧化锰生成,应是高锰酸根氧化亚铁离子生成氢氧化铁、二氧化锰,高锰酸根氧化锰离子生成二氧化锰,根据控制的PH值及原子守恒、电荷守恒可知,都有水参加反应,同时还生成氢离子,反应的离子方程式为:MnO4-+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+、2MnO4-+3Mn2++2H2O=5MnO2↓+4H+,
故答案为:MnO4-+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+;2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;
(4)锌离子水解,流程⑥中调pH=1目的是:抑制Zn2+的水解,故答案为:抑制Zn2+的水解.
点评 本题考查化学工艺流程流程、物质的分离提纯、实验控制条件的分析评价、实验方案设计,题目难度较大,理解工业流程是解题的关键,需要学生具有扎实的基础与运用知识分析解决问题的能力,注意解题中并不需要对工业流程中每一步骤都清楚.


科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液:NH4+、Ca2+、NO3-、SO42- | |
| B. | c(OH-)=1×10-13 mol•L-1的溶液:Na+、K+、ClO-、SO42- | |
| C. | 0.1 mol•L-1 FeCl2溶液:K+、Na+、SO42-、NO3- | |
| D. | 0.1 mol•L-1 KMnO4溶液:Na+、Mg2+、NO3-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4(熔融)═Na++H++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | CH3COOH?CH3COO-+H+ | D. | H2CO3?2H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.如图是过氧化氢法生产亚氯酸钠的工艺流程图:
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.如图是过氧化氢法生产亚氯酸钠的工艺流程图:查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HF>HCl>HBr>HI | B. | 微粒半径:K+>Na+>Mg2+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 还原性:Al>Mg>Na |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com