
| A. | 按系统命名法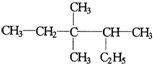 的名称为3,3-二甲基-2-乙基戊烷 的名称为3,3-二甲基-2-乙基戊烷 | |
| B. | 乙烯、乙炔是较活泼的有机物,能发生氧化反应,甲烷和苯性质较稳定,不能发生氧化反应 | |
| C. | 分子式为C5H12O的醇共有8种,其中能催化氧化成醛的同分异构体有4种 | |
| D. | A、B两种有机化合物,无论以何种比例混合,只要混合物的总质量不变,完全燃烧后,产生水的质量也不变,则A、B满足的条件必须是最简式相同 |
分析 A.主链不是最长;
B.甲烷和苯能燃烧;
C.分子式是C5H12O的醇,能被催化氧化成醛,则醇中连接羟基的碳原子上含有2个氢原子,先确定C5H12的同分异构体,用-OH取代C5H12中上的H原子,此确定醇的结构简式;
D.由两种有机物组成的混合物,无论以何种比例混合,只要混合物的总质量一定,完全燃烧生成水的质量也一定,则说明两种有机物分子中含氢质量分数相等.
解答 解:A.主链不是最长,名称为3,3,4-三甲基己烷,故A错误;
B.甲烷和苯能燃烧,发生氧化反应,故B错误;
C.分子式是C5H12O的醇,能被催化氧化成醛,则醇中连接羟基的碳原子上含有2个氢原子,C5H12的同分异构体有:CH3CH2CH2CH2CH3、CH3CH(CH3)CH2CH3、(CH3)4C,
当烷烃为CH3CH2CH2CH2CH3,-OH取代甲基上的H原子有1种结构,
当烷烃为(CH3)2CHCH2CH3,-OH取代甲基上的H原子有2种结构,
当烷烃为(CH3)4C,-OH取代甲基上的H原子有1种结构,
C5H12O的同分异构体中可以氧化为醛的醇有4种,故C正确;
D.由两种有机物组成的混合物,无论以何种比例混合,只要混合物的总质量一定,完全燃烧生成水的质量也一定,则说明两种有机物分子中含氢质量分数相等,最简式不一定相同,故D错误.
故选C.
点评 本题考查有机物的命名、同分异构体、有机物燃烧有关计算,题目难度不大,注意把握题中信息,得出两种烃分子中含氢量相等是解答该题的关键.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L乙醇分子所含的C-H键数为0.5NA | |
| B. | 3.2克O2和O3的混合气中含有的氧原子数目为0.2NA | |
| C. | 0.1mol•L-1的Al2(SO4)3溶液中,AL3+的数目小于0.2NA | |
| D. | 0.1molFe参加氧化还原反应,转移的电子数目一定是0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同浓度的四种溶液:①NH4Cl ②(NH4)2SO4 ③NH4HSO4 ④NH4Al(SO4)2溶液,c(NH4+)浓度的大小关系:②>④>③>① | |
| B. | 一定浓度的NaHS溶液中:c(Na+)+c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| C. | 若0.1 mol/L NH4Cl溶液pH=5,则其中离子浓度最大与最小的差值为(0.1-10-5)mol/L | |
| D. | 现有四种溶液:①pH=4的H2SO4溶液 ②pH=4的NH4Cl溶液 ③pH=10的氨水 ④pH=10的CH3COONa溶液,其中水电离出的氢离子浓度大小关系为:②=④>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ;
; )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
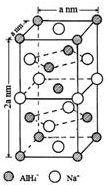 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如右图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如右图所示.  .
.  .
.  (标明配位键).
(标明配位键). 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | ① | ② | ③ | ④ |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| A. | ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大 | |
| B. | V1L④与V2L①混合,若混合后溶液pH=7,则V1<V2 | |
| C. | 分别加水稀释10倍后,四种溶液的pH①>②>④>③ | |
| D. | ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com