
��1����ҵ�Ͽ����á���������ת������������������ӦΪ�����ˮ�����ڸ��ºʹ������ڵ�����������һ����̼���������йط�Ӧ�������仯��ͼ1��
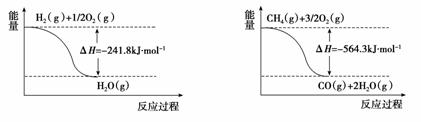
ͼ1
��÷�Ӧ���Ȼ�ѧ����ʽ_____________________________________��
��2����֪�¶ȡ�ѹǿ�Լ���ƽ�⺬����Ӱ����ͼ2����ش�
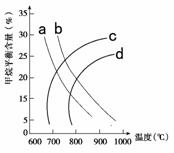
ͼ2 ͼ3
��ͼ26-2��a��b��c��d���������е���������ѹǿ�ֱ�Ϊ1Mpa��2Mpaʱ���麬�����ߣ����б�ʾ1Mpa����________��
�ڸ÷�Ӧ��ƽ�ⳣ����600 ��ʱ________700 ��(�>����<������)��
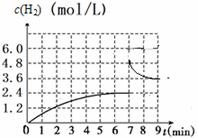
����֪����700 �棬1 MPaʱ��1 mol CH4��1 mol H2O��1 L���ܱ������з�Ӧ��6min�ﵽƽ��(��ͼ3)����ʱCH4��ת����Ϊ________________�����¶��·�Ӧ��ƽ�ⳣ��Ϊ______________(�������С�����һλ����)��
�ܴ�ͼ3�������ɵ�һ��ƽ��ڶ���ƽ�⣬ƽ���ƶ��ķ�����_____________(�������Ӧ�������淴Ӧ����)����ȡ�Ĵ�ʩ������_____________________��
��3����N2��H2Ϊ�缫��Ӧ���HCl��NH4ClΪ�������Һ��������ȼ�ϵ�أ��ŵ�����У���Һ��笠�����Ũ��������д���õ�ص�������Ӧʽ��_________________��
���𰸡�
��1��CH4(g)+H2O(g)  CO2(g)+3H2(g) ��H =+161.1KJ/mol ��2�֣�
CO2(g)+3H2(g) ��H =+161.1KJ/mol ��2�֣�
��2���� a ��2�֣� �� �� ��2�֣� ��80�G��2�֣� 276.5mol2�� L-2 ��2�֣�
���棨1�� �����������СΪԭ����1/2 ����������������2�֣�
��3��N2+6e-+8H+==2NH4+ ��2�֣�
���������⡿���⿼���Ȼ�ѧ����ʽ����ѧƽ��Ľ�������Ӱ�����أ�ԭ��ع���ԭ����
��������
��1����ͼ1��ʾ��Ӧ�Ȼ�ѧ����ʽΪ��H2(g)+1/2 O2(g)�� H2O(g) ��H1=-241.8 KJ/mol ��
2CH4(g) +3O2(g)��2CO(g) +4H2O(g) ��H2=-563.4KJ/mol ��,�����ˮ�����ڸ��ºʹ������ڵ�����������һ����̼�������ķ���ʽΪ��CH4��g��+H2O��g�� CO��g��+3H2��g���ۣ����=��-3���٣����ݸ�˹���ɣ��С�H3=��H2-3����H1=-564.3+3��241.8= +161.1KJ/mol���ʸ÷�Ӧ�Ȼ�ѧ����ʽΪ��CH4(g)+H2O(g)
CO��g��+3H2��g���ۣ����=��-3���٣����ݸ�˹���ɣ��С�H3=��H2-3����H1=-564.3+3��241.8= +161.1KJ/mol���ʸ÷�Ӧ�Ȼ�ѧ����ʽΪ��CH4(g)+H2O(g)  CO2(g)+3H2(g) ��H =+161.1KJ/mol��(2)���ٶ������ȷ�Ӧ��ѹǿһ��ʱ�������¶ȣ�ƽ�������ƶ������麬��Ӧ���٣����ų�����c��d���¶�һ��ʱ������ѹǿ��ƽ�������ƶ������麬�������ӣ�������a��ʾ1MPaʱ�ļ��麬�����ߣ������ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���Kֵ����K(600 ��)��K(700 ��)��
CO2(g)+3H2(g) ��H =+161.1KJ/mol��(2)���ٶ������ȷ�Ӧ��ѹǿһ��ʱ�������¶ȣ�ƽ�������ƶ������麬��Ӧ���٣����ų�����c��d���¶�һ��ʱ������ѹǿ��ƽ�������ƶ������麬�������ӣ�������a��ʾ1MPaʱ�ļ��麬�����ߣ������ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���Kֵ����K(600 ��)��K(700 ��)��
�۸�����Ŀ�������ݶԷ�Ӧ��������ʽ���̷�������
CH4��g��+H2O��g�� CO��g��+3H2��g��
CO��g��+3H2��g��
��ʼ��mol/L�� 1 1 0 0
ת����mol/L�� 0.8 0.8 0.8 2.4
ƽ�⣨mol/L�� 0.2 0.2 0.8 2.4 �ʿ�֪��CH4��ת����Ϊ80%��
ƽ�ⳣ��K=c(CO)��c(H2)3/c(CH4)c(H2O)=0.8��2.43/0.2��0.2=276.5���ܡ���ͼ3��������7minʱ��H2Ũ��˲����2.4mol/L����Ϊ4.8mol/L�������ŷ�Ӧ�Ľ���Ũ�Ȳ��ϼ�С����֪ƽ�����������ƶ����ı�����������Ǽ�����������������������СΪԭ����1/2 ��(3)��طŵ�ʱ������������ԭ��Ӧ������Һ��笠�����Ũ���������֪������N2�õ����ӱ���ԭΪNH4+���缫����ʽΪ��N2+6e-+8H+==2NH4+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
COCl2�ķֽⷴӦΪCOCl2(g)===Cl2(g)��CO(g)����H����108 kJ·mol��1����Ӧ��ϵ�ﵽƽ������ʵ�Ũ���ڲ�ͬ�����µı仯״������ͼ��ʾ(��10 min��14 min��COCl2Ũ�ȱ仯����δʾ��)��

�ټ��㷴Ӧ�ڵ�8 minʱ��ƽ�ⳣ��K��__________��
�ڱȽϵ�2 min��Ӧ�¶�T(2)���8 min��Ӧ�¶�T(8)�ĸߵͣ�T(2)________T(8)(�<������>������)��
����12 minʱ��Ӧ���¶�T(8)�����´ﵽƽ�⣬���ʱc(COCl2)��________mol·L��1��
�ܱȽϲ���CO��2��3 min��5��6 min��12��13 minʱƽ����Ӧ����[ƽ����Ӧ���ʷֱ���v(2��3)��v(5��6)��v(12��13)��ʾ]�Ĵ�С_____________________________��
�ݱȽϷ�Ӧ��COCl2��5��6 min��15��16 minʱƽ����Ӧ���ʵĴ�С��v(5��6)________v(15��16)(�<������>������)��ԭ����______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������������Һ���й���������ȷ����(����)
| ��� | �� | �� | �� | �� |
| pH | 11 | 11 | 3 | 3 |
| ��Һ | ��ˮ | ����������Һ | ���� | ���� |
A.�ۢ��зֱ���������Ĵ����ƾ��������Һ��pH������
B���ڢ�����Һ�������ϣ�������Һ��c(H��)��c(OH��)
C���ֱ��ˮϡ��10����������Һ��pH �٣��ڣ��ܣ���
D��V1 L ����V2 L �ٻ�ϣ�����Ϻ���ҺpH��7����V1�� V2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ������п��������ϡ���ᷴӦ����Ӧ���Һ�м���ijЩ���ʣ������ж���ȷ����(����)
A����������ˮ������H2���ʼ�С��H2�������
B������NH4HSO4���壬����H2���ʲ��䣬H2�������
C������CH3COONa���壬����H2���ʼ�С��H2�����С
D���μ�����CuSO4��Һ������H2���ʱ��H2�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и�ͼ�����һ�µ��ǣ� ��

A��ͼ�ٿ��Ա�ʾ��ij��ѧƽ����ϵ�ı��¶Ⱥ�Ӧ������ʱ��ı仯
B����ͼ����ʾװ������AlCl3��Һ�Ʊ���ˮAlCl3
C��ͼ�ۿ��Ա�ʾ��һ������������Һ����εμ�һ��Ũ������������Һʱ����Al(OH)3���������ʵ����仯
D��ͼ�ܵ�ⱥ��ʳ��ˮ��װ���У���ҺA��B����ˮ�������c(H��)��A>B
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪�� 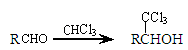 ��-R��ʾ������
��-R��ʾ������
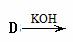 ���״�+�������
���״�+�������
�������з�Ӧ·�ߺϳɽᾧõ��(ֻ�г����ַ�Ӧ����)
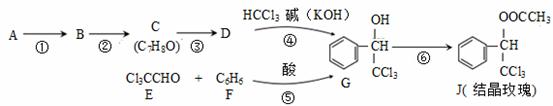
��1��A�DZ���һ��ͬϵ���ͬ�����£�������������������ܶ���46����A�������� ��
��2��C�еĹ������� ��
��3����Ӧ�۵Ļ�ѧ����ʽΪ ��
��4������Ӧ·�ߢܵõ��ĸ������ˮ��ȡ����Һ���ܳ�ȥ�ĸ������� ��
��5����֪��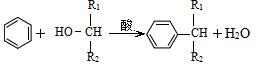 ����Ӧ·�ߢݵõ�һ�ָ������˴Ź���������4�ַ壬�������շ�����֮��Ϊ ��
����Ӧ·�ߢݵõ�һ�ָ������˴Ź���������4�ַ壬�������շ�����֮��Ϊ ��
��6��G��ͬ���칹��L��FeCl3��Һ��ɫ��������������ˮ��Ӧδ����ɫ������������L��NaOH���Ҵ���Һ���ȣ������л���Ľṹ��ʽΪ (ֻдһ��)��
��7���Ļ�ѧ����ʽ�� ��
��8��C�ж���ͬ���칹�壬�������ڷ����廯������� �֣�������C����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
CuSO4��һ����Ҫ�Ļ���ԭ�ϣ����й��Ʊ�;����������ͼ��ʾ������˵������ȷ���ǣ� ��

A��;�������û�����H2SO4��HNO3���ʵ���֮�����Ϊ3��2
B�������;���١��ۣ�;���ڸ��õ���������ɫ��ѧ˼��
C��1molCuSO4��1100�����û������X��O2Ϊ0.75mol
D��Y������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и�������,���۵��ɸߵ��͵�˳��������ȷ����(�� ��)
A.CH4>SiH4>GeH4>SnH4
B.KCl>NaCl>MgCl2>MgO
C.Rb>K>Na>Li
D.���ʯ>SiC >Si >S
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ͼ��ʾ��װ���У���ֱͨ����5 minʱ��ͭ�缫��������2.16 g���Իش��������⡣
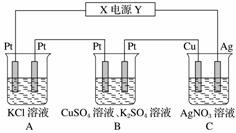
(1)��Դ��X�缫Ϊֱ����Դ��________����
(2)pH�仯��A��________��B��________��C��________(���������С�����䡱)��
(3)ͨ��5 minʱ��B�й��ռ�224 mL(��״����)���壬��Һ���Ϊ200 mL����ͨ��ǰCuSO4��Һ�����ʵ���Ũ��Ϊ________(����ǰ����Һ����ޱ仯)��
(4)��A��KCl��������Һ�����Ҳ��200 mL��������Һ��pHΪ__________(����ǰ����Һ����ޱ仯)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com