
【题目】在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量.
(1)写出该反应的热化学方程式: .
(2)已知H2O(l)═H2O(g);△H=+44kJmol﹣1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是kJ.
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是 .
(4)已知N2(g)+2O2(g)═2NO2(g);△H=+67.7kJmol﹣1,N2H4(g)+O2(g)═N2(g)+2H2O (g);△H=﹣534kJmol﹣1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式 .
【答案】
(1)N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣641.625kJ?mol﹣1
(2)408.8
(3)产物为氮气和水,无污染
(4)2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=﹣1135.7kJ?mol﹣1
【解析】解:(1.)已知0.4mol液态肼和足量H2O2(l)反应生成氮气和水蒸气时放出256.64kJ的热量,依据热化学方程式的书写原则,结合定量关系写出,1mol肼和过氧化氢反应生成氮气和水蒸气放出的热量= ![]() =641.6KJ,所以热化学方程式为:N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=﹣641.625kJ/mol,
=641.6KJ,所以热化学方程式为:N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=﹣641.625kJ/mol,
故答案为:N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=﹣641.625kJ/mol;
(2.)16g液态肼物质的量= ![]() =0.5mol,
=0.5mol,
由①N2H4(1)+2H2O2(1)=N2(g)+4H2O(g);△H=﹣641.6kJ/mol;
②H2O(1)=H2O(g)△H=+44kJ/mol,
结合盖斯定律的内容和要求,可以把②×4方向倒转得到③4H2O(g)=4H2O(l)△H=﹣44×4kJ/mol=﹣176kJ/mol,
①+③得到N2H4(1)+2H2O2(1)=N2(g)+4H2O(l);△H=﹣817.6kJ/mol,
所以0.5mol液态肼与足量双氧水反应生成氮气和液态水时,放出的热量= ![]() =408.8kJ,
=408.8kJ,
故答案为:408.8;
(3.)反应应用于火箭推进器,除释放出大量热量和快速生成大量气体产生巨大推力外,反应的生成物是氮气和水,很突出的优点是对环境无污染;
故答案为:产物为氮气和水,无污染;
(4.)①N2(g)+2O2(g)═2NO2(g),△H=+67.7KJmol﹣1;
②N2H4(g)+O2(g)═N2(g)+2H2O (g),△H=﹣534KJmol﹣1
将方程式2②﹣①得2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=2(﹣534KJmol﹣1)﹣(+67.7KJmol﹣1)=﹣1135.7kJmol﹣1 ,
故答案为:2N2H4(g)+2 NO2 (g)═3N2(g)+4 H2O(g);△H=﹣1135.7kJmol﹣1 .
(1)根据题给条件厉害书写热化学方程式的原则写出;(2)依据(2)中写出的热化学方程式和H2O(1)=H2O(g)△H=+44kJ/mol,利用盖斯定律写出热化学方程式计算;(3)依据反应产物的性质分析无污染物产生分析;(4)根据盖斯定律计算焓变,并书写热化学方程式.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】工业制硫酸中一步重要的反应是:SO2在400~500℃的条件下进行催化氧化:2SO2+O2![]() 2SO3 , 其正反应为放热反应.如果该反应是在密闭容器中进行的,下述有关说法中错误的是( )
2SO3 , 其正反应为放热反应.如果该反应是在密闭容器中进行的,下述有关说法中错误的是( )
A.使用催化剂是为了加快反应速率,提高生产效率
B.在上述条件下,反应达平衡时容器中存在SO2、O2、SO3三种物质
C.生产中一定要不断提供热量,使温度达到400~500℃
D.达到平衡时,SO2的浓度与SO3的浓度可能相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是产生和收集气体的实验装置,该装置最适合于( )
A.用浓硝酸和Cu反应制取NO2
B.用浓盐酸和MnO2反应制取Cl2
C.用NH4Cl和Ca(OH)2反应制取NH3
D.用H2O2溶液和MnO2反应制取O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关仪器用途的说法正确的是 ( )
A. 试管、烧杯均可用于给液体、固体加热
B. 使食盐水中NaCl结晶析出时,用到的仪器有坩埚、酒精灯、玻璃棒、泥三角
C. 区别NaCl、Na2SO4时常用到胶头滴管、试管
D. 漏斗不可用于过滤溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,且原子序数依次增大,其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)比E核外电子数少5的元素的原子核外电子排布式是,A、B、C、D的第一电离能由小到大的顺序为。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是。
(3)A的氢化物属于(填“极性”或“非极性”)分子,D的低价氧化物分子的空间构型是。
(4)A、E形成的某种化合物的晶胞结构如图所示,则其化学式为(每个球均表示1个原子)。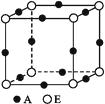
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是( )
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年初天津连续出现了严重的雾霾天气,给人们的出行及身体造成了极大的危害.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)利用钠碱循环法可脱除烟气中的SO2 . ①在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 .
②吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
n(SO32﹣):n(HSO3﹣) | 91:9 | 1:l | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
由上表判断,NaHSO3溶液显性(填“酸”、“碱”或“中”),用化学平衡原理解释: .
③当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下: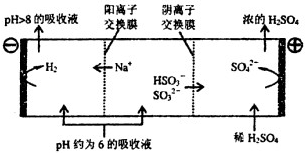
写出HSO3﹣在阳极放电的电极反应式: , 当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.
(2)用CH4催化还原NOx可以消除氮氧化物的污染.例如: CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g);△H=﹣574kJmol﹣1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=﹣1160kJmol﹣1
若用标准状况下4.48L CH4还原NO2至N2 , 整个过程中转移的电子总数为(阿伏伽德罗常数的值用NA表示),放出的热量为kJ.
(3)工业上合成氮所需氢气的制备过程中,其中的一步反应为:CO(g)+H2O(g) ![]() CO2(g)+H2(g);△H<0 一定条件下,将CO(g)与H2O(g)以体积比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为1:6,则平衡常数K= .
CO2(g)+H2(g);△H<0 一定条件下,将CO(g)与H2O(g)以体积比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为1:6,则平衡常数K= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com