
【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):

实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
(1)该反应的离子方程式 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 < (填实验序号)。
(3)若实验①在2 min末收集了2.24 mL CO2(标准状况下),则在2 min末, c(MnO4-)=__________mol/L(假设混合液体积为50 mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。(一条即可)
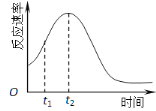 (5)小组同学发现反应速率总是如右图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如右图,其中t1~t2时间内速率变快的主要原因可能是:
① ;② 。
【答案】(1)2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)浓度;①<②;(3)0.0056;
(4)KMnO4,溶液完全褪色所需时间或产生相同体积气体所需的时间;
(5)①该反应放热;②产物Mn2+是反应的催化剂。
【解析】
试题分析:(1)高锰酸钾溶液的强氧化性,把草酸氧化成CO2,根据化合价升降法进行配平,其离子反应方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;(2)对比表格数据,草酸的浓度不一样,因此是浓度对化学反应速率的影响,浓度越大,反应速率越快,①<②;(3)根据反应方程式,求出消耗的n(KMnO4)=2.24×10-3×2/(22.4×10)mol=2×10-5mol,剩余n(KMnO4)=(30×10-3×0.01-2×10-5)mol=2.8×10-4mol,c(KMnO4)=2.8×10-4/50×10-3mol·L-1=0.0056mol·L-1;(4) KMnO4,溶液完全褪色所需时间或产生相同体积气体所需的时间;(6)①此反应是放热反应,温度升高,虽然反应物的浓度降低,但温度起决定作用;②可能产生的Mn2+是反应的催化剂,加快反应速率。


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】下列各组晶体中,化学键种类相同,晶体类型也相同的是
A. SO2与SiO2 B. NaCl与HCl C. CO2与H2O D. CCl4与KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A.若2H2(g)+O2(g)=2H2O(g)ΔH=—483.6kJ·mol-1,则H2燃烧热为241.8kJ·mol-1
B.若C(石墨,s)=C(金刚石,s)ΔH>0,则石墨比金刚石稳定
C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=—57.4kJ·mol-1,则20.0gNaOH固体与稀盐酸完全中和,放出28.7kJ的热量
D.已知2C(s)+2O2(g)=2CO2(g)ΔH1;2C(s)+O2(g)=2CO(g)ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中加入BaCl2溶液生成白色沉淀,再加入稀硝酸沉淀不溶解也无气体逸出,则这种溶液中
A.一定含有SO42– B.一定含有Ag+
C.可能含有SO42– 或Ag+ 或CO32– D.可能含有SO42– 或Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是生产氮肥、尿素等物质的重要原料。
(1)合成氨反应N2(g)+ 3H2(g)![]() 2NH3(g)在一定条件下能自发进行的原因是 。电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应式是 。
2NH3(g)在一定条件下能自发进行的原因是 。电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应式是 。
(2)氨碳比[n(NH3)/n(CO2)]对合成尿素[2NH3(g)+CO2(g)![]() CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
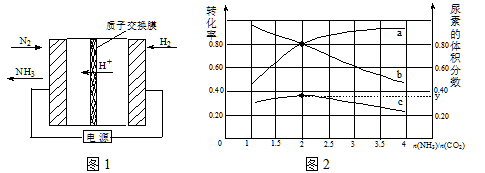
(3)废水中含氮化合物的处理方法有多种。
①用次氯酸钠氧化氨气,可以得到N2H4的稀溶液,该反应的化学方程式是_____________。
②用NaClO溶液也可将废水中的NH4+ 转化为N2。若处理过程中产生N2 0.672 L(标准状况),则需要消耗0.3 mol·L-1的NaClO溶液 L。
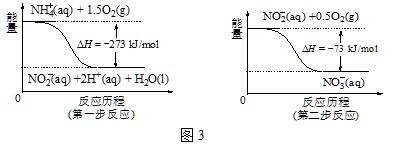
③在微生物的作用下,NH4+ 经过两步反应会转化为NO3-,两步反应的能量变化如图3所示。则1 mol NH4+ (aq)全部被氧化成NO3-(aq)时放出的热量是 kJ。
④用H2催化还原法可降低水中NO3-的浓度,得到的产物能参与大气循环,则反应后溶液的pH (填“升高”、“降低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com