
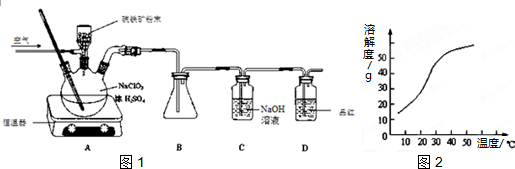
分析 (1)NaClO3与FeS2的反应中,氯从+5价变为+4价,铁从+2价变为+3价,硫从-2价变为+6价,根据化合价升降法结合电荷守恒和元素守恒配平离子方程式;
(2)ClO2熔点为-59℃,沸点为11.0℃,B中要收集ClO2,要有冰水浴;
(3)ClO2有强氧化性,能使品红褪色,通过品红可以判断ClO2是否吸收完全;
(4)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法;
(5)①ClO2有强氧化性,在酸性条件下将碘离子氧化成碘单质,同时生成氯离子,根据电荷守恒和元素守恒书写离子方程式;
②根据关系式2ClO2~5I2~10Na2S2O3计算c(ClO2).
解答 解:(1)NaClO3与FeS2的反应中,氯从+5价变为+4价,铁从+2价变为+3价,硫从-2价变为+6价,根据化合价升降法结合电荷守恒和元素守恒配平离子方程式为15ClO3-+FeS2+14H+=15ClO2+Fe3++2SO42-+7H2O,
故答案为:15;1;14;15;1;2;7;
(2)ClO2熔点为-59℃,沸点为11.0℃,B中要收集ClO2,要用冰水浴装置,
故答案为:冰水浴;
(3)ClO2有强氧化性,能使品红褪色,所以装置D的作用是检验ClO2是否吸收完全,
故答案为:检验ClO2是否吸收完全;
(4)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法,防止析出晶体NaClO2•3H2O,趁热过滤,
故答案为:蒸发结晶;趁热过滤;
(5)①ClO2有强氧化性,在酸性条件下将碘离子氧化成碘单质,同时生成氯离子,反应的离子方程式为2ClO2+10I-+8H+=2Cl-+5I2+4H2O,
故答案为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O;
②设原ClO2溶液的浓度为x,
2ClO2~5I2~10Na2S2O3
2mol 10mol
$\frac{10{\;}^{-2}x×V{\;}_{1}×10{\;}^{-3}}{1{0}^{-1}}$ 1×10-3cV2mol
x=$\frac{2cV{\;}_{2}}{{V}_{1}}$mol/L=$\frac{135CV{\;}_{2}}{V{\;}_{1}}$g/L,
故答案为:$\frac{135CV{\;}_{2}}{V{\;}_{1}}$.
点评 本题考查物质的制备、对信息的利用、对装置的理解、氧化还原反应等,理解反应原理,掌握实验基本操作是解题的关键,同时考查学生分析问题、解决问题的能力,难度较大,注意氧化还原反应的计算.


 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH等于7的氨水与硫酸铵的混合溶液中c(NH4+)与c(SO42-)之比 | |
| B. | 相同温度下,1L 0.2mol/L的CH3COOH溶液与2L 0.1mol/L的CH3COOH溶液中所含的n(H+)之比 | |
| C. | NaHS溶液中c(Na+)与c(HS-)之比 | |
| D. | pH=12的KOH溶液与pH=12的Ba(OH)2溶液中c(OH-)之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 实验现象 | 结论 |
| ①用刀切开金属钠,观察切开的金属钠表面 | 切面变暗淡 | 化学方程式为: 4Na+O2═2Na2O |
| ②把一小块钠放在石棉网上加热 | 生成淡黄色的固体 | 化学方程式为: 2Na+O2═Na2O2 |
| ③把一小块金属钠投入滴有酚酞的水中 | 溶液变红色 | 证明有NaOH生成. |
④如图装置收集一试管气体,将试管口向下移近酒精灯火焰  | 听到轻微的“噗”声 | 有氢气生成. 钠与水反应的离子方程式为: 2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com