
| A. | N | B. | Ni | C. | Cr | D. | Cu+ |
科目:高中化学 来源: 题型:解答题
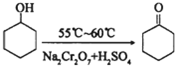
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3、20℃) | 溶解性 |
| 环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A>B>C>D | |
| B. | 元素金属性:B>A,元素非金属性:D>C | |
| C. | 离子半径:D(n+1)->Cn->B(n+1)+>An+ | |
| D. | 原子序数:b>a>c>d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 甲 | 乙 | 丙 | 丁 | |
| A | FeCl3 | FeCl2 | Fe2O3 | Fe(OH)3 |
| B | Cu | CuO | CuSO4 | CuCl2 |
| C | NO | HNO3 | NO2 | NH3 |
| D | Si | Na2SiO3 | SiO2 | SiF4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属与非金属化合时,都可以形成离子键 | |
| B. | 电负性相差越大的元素原子间越容易形成共价键 | |
| C. | 若元素原子核外电子数为a,则其核外共有a种不同运动状态的电子 | |
| D. | 同周期主族元素从左到右,第一电离能和电负性均依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 工作一段时间后,电解液中KOH的物质的量不变 | |
| C. | 该燃料电池的总反应方程式为:2H2+O2═2H2O | |
| D. | H2通入的一极为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与水反应时增大水的用量 | |
| B. | CaCO3与盐酸反应制取CO2时,改用浓硫酸 | |
| C. | C(s)+H2O(g)?CO(g)+H2(g),将碳块改成碳粉进行实验 | |
| D. | 粗锌与盐酸反应,将粗锌换成纯锌 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com