
| A. | 将过量的SO2通入NaClO溶液中:SO2+ClO-+H2O=HClO+HSO3- | |
| B. | 双氧水作脱氯剂,用于消除水中的氯气:Cl2+H2O2=2HCl+O2 | |
| C. | 用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| D. | “84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:ClO3-+5Cl-+6H+=3Cl2↑+3H2O |
分析 A.次氯酸根离子具有强的氧化性,能够氧化二氧化硫生成硫酸根离子;
B.氯气与过氧化氢发生氧化还原反应生成氧气;
C.用惰性电极电解饱和氯化镁溶液,生成氢氧化镁沉淀;
D.84消毒液的成分为NaClO.
解答 解:A.NaClO溶液中通入过量SO2气体的离子反应为ClO-+H2O+SO2═2H++Cl-+SO42-,故A错误;
B.氯气与过氧化氢发生氧化还原反应生成氧气,方程式为Cl2+H2O2=2HCl+O2,故B正确;
C.用惰性电极电解饱和氯化镁溶液:Mg2++2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+Mg(OH)2↓,故C错误;
D.“84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:ClO-+Cl-+2H+=Cl2↑+H2O,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,明确在离子反应中哪些物质应保留化学式及反应的实质是解答本题的关键,题目难度中等.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 白磷和红磷互为同素异形体 | |
| B. | CH3-CH2OH和 CH3-O-CH3互为同分异构体 | |
| C. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | |
| D. | ${\;}_{2}^{4}$He的最外层电子数为2,所以${\;}_{2}^{4}$He具有较强的金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
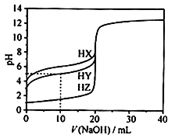 25℃时,用0.1000mol•L-1的NaOH溶液分别滴定20.00mL均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法错误的是( )
25℃时,用0.1000mol•L-1的NaOH溶液分别滴定20.00mL均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法错误的是( )| A. | HZ是强酸,HX、HY是弱酸 | |
| B. | 根据滴定曲线,可得Ka(HY)≈10-5 | |
| C. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) | |
| D. | 将上述HY与HZ溶液等体积混合达到平衡时:C(H+)=c(OH-)=c(Z-)+c(Y-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为补充土壤中的钾元素,可在田间焚烧秸秆 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| C. | 石油的分馏、催化裂化、裂解等石油加工方法,其目的均为得到更多的汽油 | |
| D. | 做衣服的棉和麻灼烧有烧焦羽毛的气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电解Na2SO3溶液,可再生NaOH,同时得到H2SO4,其原理如图所示.(电极材料为石墨)下列说法正确的是( )
电解Na2SO3溶液,可再生NaOH,同时得到H2SO4,其原理如图所示.(电极材料为石墨)下列说法正确的是( )| A. | 图中a极要连接电源的负极,C口流出的物质是亚硫酸 | |
| B. | b放电的电极反应式为SO32-+H2O-e-═SO42-+2H+ | |
| C. | 电解过程中若消耗12.6g Na2SO3,则阴极区变化的质量为4.4g(假设该过程中所有液体进出口密闭) | |
| D. | 电子由a经内电路流向b电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
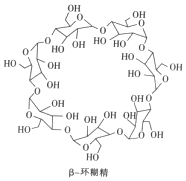 β-环糊精(简称β-CD)是淀粉部分水解后的产物,其在食品加工、医学及日用化工中的用途非常广泛.下列有关β-CD的说法不正确的是( )
β-环糊精(简称β-CD)是淀粉部分水解后的产物,其在食品加工、医学及日用化工中的用途非常广泛.下列有关β-CD的说法不正确的是( )| A. | 有两种含氧官能团 | B. | 酸性条件下能继续水解 | ||
| C. | 相对分子质量为1134 | D. | 其结构中含有20个羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
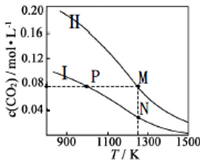 两个容积均为10L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g)?N2(g)+2CO2(g),起始物质的量见下表.实验测得两容器不同温度下达到平衡时CO2的物质的量浓度如图所示,下列说法错误的是( )
两个容积均为10L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g)?N2(g)+2CO2(g),起始物质的量见下表.实验测得两容器不同温度下达到平衡时CO2的物质的量浓度如图所示,下列说法错误的是( )| 容器 | 起始物质的量 | ||
| NO | CO | ||
| Ⅰ | 1mol | 0.5mol | |
| Ⅱ | 2mol | 1mol | |
| A. | 反应N2(g)+2CO2(g)?2NO(g)+2CO(g)的△H<0,△S>0 | |
| B. | P点的速率比M点慢 | |
| C. | M、N两点容器内的压强:P(M)<2P(N) | |
| D. | N点的平衡常数为44.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com