
��9�֣��ճ������г����Ľ������������Ͻ𡢸����ȣ�ij��ѧʵ��С�����ⶨ���ֽ������ϵ���ʴ�ԣ�����ҩƷ���Լ��У����Ͻ𡢸�����CO2��SO2��ˮ��
��1�����������ʵ����Ʊ�������ʵ��Ŀ�ĵ�һ���������Ӧ��ʵ���ţ�
| ʵ���� | �������� | �� Һ | ʵ��Ŀ�� |
| �� | ���Ͻ� | CO2 �� H2O | ��̽����ͬ��Һ�Խ������ϵĸ�ʴ���ʣ� ��̽����ͬ�������ϵĸ�ʴ���ʣ� |
| �� |
|
| |
| �� |
|
|
(2)��10%���������¶ȶ����Ͻ�ĸ�ʴ����Ӱ���ϵ����ͼ�����Ͻ���40��ʱ�ĸ�ʴ������20��� ��.
(3)��������ͼ���У��������Ͻ���CO2��Һ��SO2��Һ�и�ʴ�������¶ȱ仯��ϵ��Ԥ�ڽ��ʾ��ͼ������a�㿪ʼ����
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
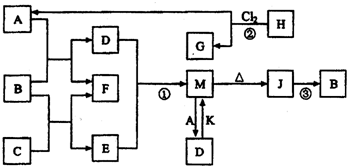 ��1��C�д��ڵĻ�ѧ������Ϊ
��1��C�д��ڵĻ�ѧ������Ϊ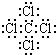

| ||
| ����ʯ |
| ||
| ����ʯ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2012?����һģ����֪AΪ��ѧ��ѧ�е�һ���Σ�B��CΪ�ճ������г����Ľ�����ͨ��������D��GΪ��ɫ��ζ���壮��֪�ö��Ե缫���A��Һһ��ʱ�����ֻ��C��D��E��ϡ��Һ��������֮���ת����ϵ��ͼ�����ַ�Ӧ��������ȥ����
��2012?����һģ����֪AΪ��ѧ��ѧ�е�һ���Σ�B��CΪ�ճ������г����Ľ�����ͨ��������D��GΪ��ɫ��ζ���壮��֪�ö��Ե缫���A��Һһ��ʱ�����ֻ��C��D��E��ϡ��Һ��������֮���ת����ϵ��ͼ�����ַ�Ӧ��������ȥ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�



�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�� | A | B | C | D | E |
| �й����ʻ�ṹ��Ϣ | �����ǿ�������Ҫ�ɷ�֮һ�����⻯��ˮ��Һ�ʼ��� | ԭ�Ӻ���������δ�ɶԵ��� | �ճ������г����Ľ�����ͨ���õ�ⷨұ���䵥�� | ��������Ӵ�������λ����� | �����ж���������Ϊ��ɫ���壬����������ˮ���� |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ���ͼ��ʾ������ת����ϵ�У������ճ������г����Ľ������ҡ��������dz��������嵥�ʣ��Ҷ�Ϊ����ɫ���壮����B������C�������������İ��̣�D�Ǻ�ˮ��Ũ����ߵ��Σ����ַ�Ӧ��������P�ܼ�ˮ����ȥ����
���ͼ��ʾ������ת����ϵ�У������ճ������г����Ľ������ҡ��������dz��������嵥�ʣ��Ҷ�Ϊ����ɫ���壮����B������C�������������İ��̣�D�Ǻ�ˮ��Ũ����ߵ��Σ����ַ�Ӧ��������P�ܼ�ˮ����ȥ����
| ||
| ||
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com